
● 期刊:Science
● IF=41.037
● 发表时间:2019-11-07
研究背景
癌细胞具有巨大的合成代谢和能量需求,癌细胞通过糖酵解途径将葡萄糖代谢为乳酸时,谷氨酰胺聚糖为三氯乙酸循环提供燃料,产生代谢中间体作为脂质、蛋白质和核酸的构建,这些物质对合成代谢生长和增殖至关重要。
有科学家推测,阻断谷氨酰胺代谢,说不定就能抑制肿瘤的生长,甚至能够解除肿瘤对免疫系统的压制。
之前有研究表明一种叫做DON的药物,能有效抑制那些使用谷氨酰胺的酶,从而让癌细胞无法利用谷氨酰胺。
这样一来,癌细胞就会被“饿死”。
然而一系列临床试验表明,这种药物的毒副作用极大,DON不仅能影响癌细胞,还能影响正常细胞。
此次研究发现,DON的一种前体物质JHU083可以在不影响正常细胞的前提下作用到癌细胞,从而抑制癌细胞中的谷氨酰胺。
研究方法
转录组、蛋白组、LC-MS/MS、Sea horse
研究过程及结果
1. JHU083具有很好的抗癌效果
研究团队在小鼠身上分别接种结肠癌MC38、淋巴瘤EL-4、结肠癌CT26和黑色素瘤B16这4种癌细胞之后,注射JHU083,观察抗癌效果。
研究发现对于每种测试的肿瘤类型,JHU083的治疗均导致肿瘤生长显着减少和存活率提高,而且抗癌效果还非常持久。
通过代谢分析后发现,阻断谷氨酰胺代谢通过TCA循环以及糖酵解和相关途径抑制了葡萄糖代谢,从而破坏了Warburg效应。这种抑制代谢活动的同时伴随着肿瘤内谷氨酰胺和葡萄糖含量的显著增加,以及肿瘤低氧的降低。这些发现表明,阻断谷氨酰胺代谢可严重破坏肿瘤的代谢,对肿瘤微环境(TME)内的营养环境有显著影响。
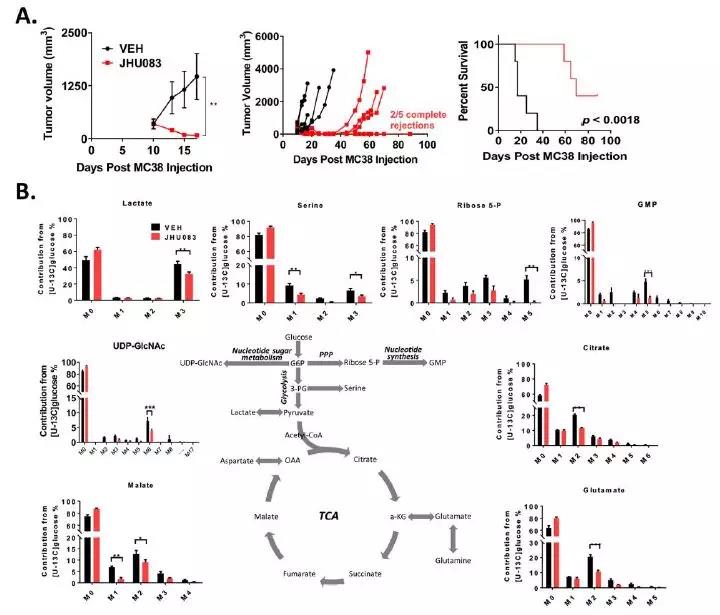
2. 阻断谷氨酰胺代谢会增强免疫治疗的疗效
由于JHU083治疗改善了TME,接下来要确定阻断谷氨酰胺代谢是否会增强免疫治疗的疗效。为了消除阻断谷氨酰胺代谢对淋巴细胞功能带来的损害,因此在开始过继细胞转移(ACT)免疫治疗之前进行代谢治疗。
在过继转移活化的OVA特异性OTI T细胞之前,将含有表达OVA的B16黑色素瘤的小鼠用JHU083预处理3天。经治疗的小鼠显示出肿瘤控制和存活的改善,表明谷氨酰胺阻断可以调节TME以增强ACT。
接下来,将谷氨酰胺靶向疗法与PD-1检查点免疫疗法相结合。研究发现,同时给予谷氨酰胺拮抗剂和抗PD-1治疗的荷瘤小鼠显示出显著改善的抗肿瘤效果,在MC38模型中完全缓解率接近100%。
阻断谷氨酰胺代谢并不会使抗肿瘤免疫细胞代谢失活,相反,似乎显著增强了它们的功能和效果。为了确定单独阻断谷氨酰胺代谢也能增强内源性抗肿瘤反应,用JU083单一疗法对的小鼠进行了实验,结果表明JHU083单药引起的谷氨酰胺阻断,不需要额外的免疫治疗,可显著增强内源性抗肿瘤免疫,更普遍的是,肿瘤免疫排斥反应和适应性免疫记忆可通过这种代谢干预单独触发。
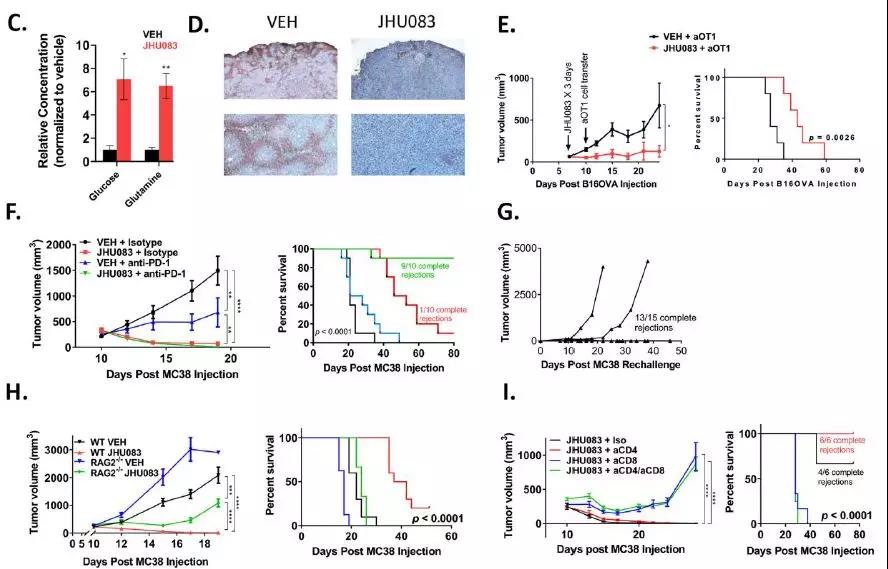
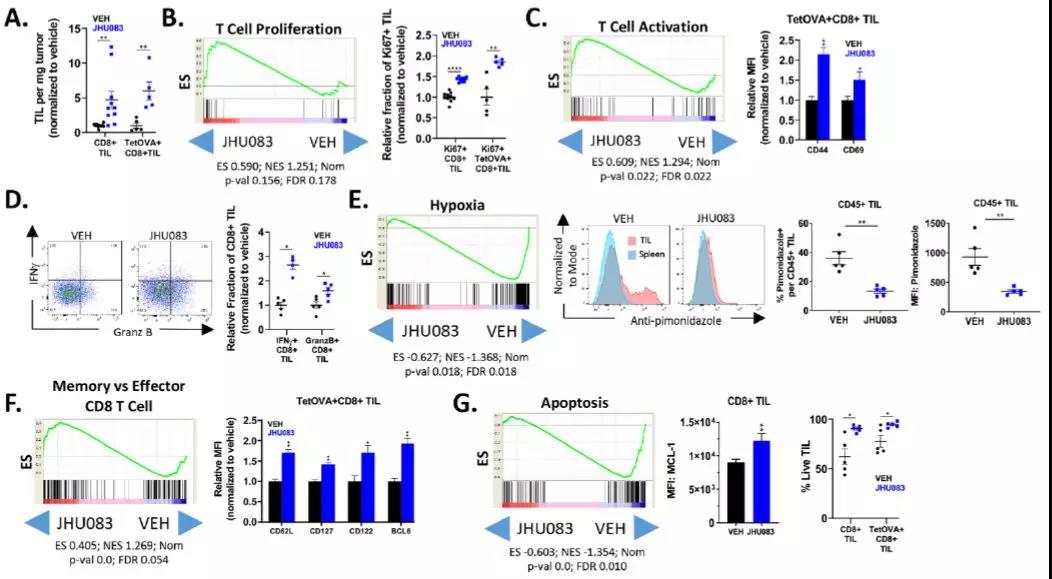
3. JHU083治疗通过影响浸润性CD8+T细胞,增强抗肿瘤反应
为了进一步研究JU083单一疗法增强抗肿瘤反应的机制,检测了载药和JU083治疗的小鼠的肿瘤浸润淋巴细胞(TIL)。结果发现,JU083治疗后浸润性CD8+T细胞显著增加,并且这些TIL中有更大比例是抗原特异性的。
RNA测序后发现,治疗组和未治疗组小鼠TIL的显著差异,二者之间有4313个基因的表达存在显著差异。基因集富集分析(GSEA)显示,来自治疗小鼠的浸润性CD8+T具有高增殖性,这些变化也影响到相应蛋白质表达水平。
分析后还发现,PD-1和LAG-3这俩免疫检查点双阳性的T细胞比例低,IFNγ升高、颗粒酶B和IL-2等抗癌物质升高等特点。
此外,研究人员还观察到,与长寿记忆T细胞相关的基因表达升高,与凋亡有关的基因表达显著降低。这些结果表明,谷氨酰胺阻断能以细胞固有的方式激活T细胞,使其向高度激活、长寿、记忆样分化状态发展。
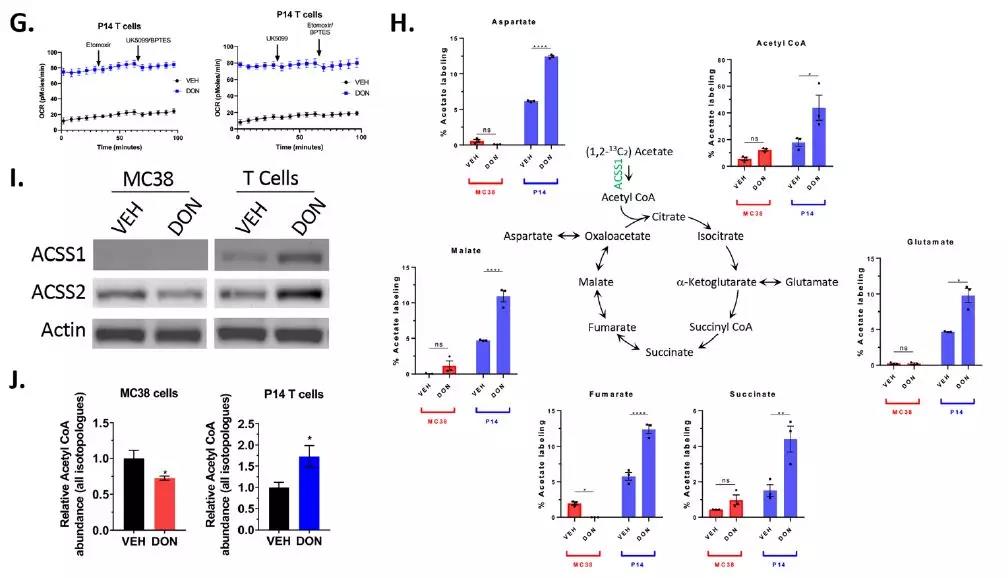
4. JHU083是通过影响代谢发挥作用
代谢流分析显示,阻断谷氨酰胺可抑制癌细胞和活化CD8+ T细胞的有氧糖酵解。在DON处理的T细胞中,代谢程序的变化与线粒体蛋白TOMM20,CPT1α和VDAC1的上调有关。并且T细胞中有利于氧化磷酸化(OXPHOS)而不是Warburg效应的功能变化与T细胞记忆表型的代谢特征一致。
另外还发现DON处理的T细胞抑制了长链脂肪酸,丙酮酸和谷氨酰胺的线粒体运输,但仍保持着显着的OXPHOS水平。在谷氨酰胺阻断的情况下,T细胞利用乙酸作为TCA循环的碳源具有显著的能力。
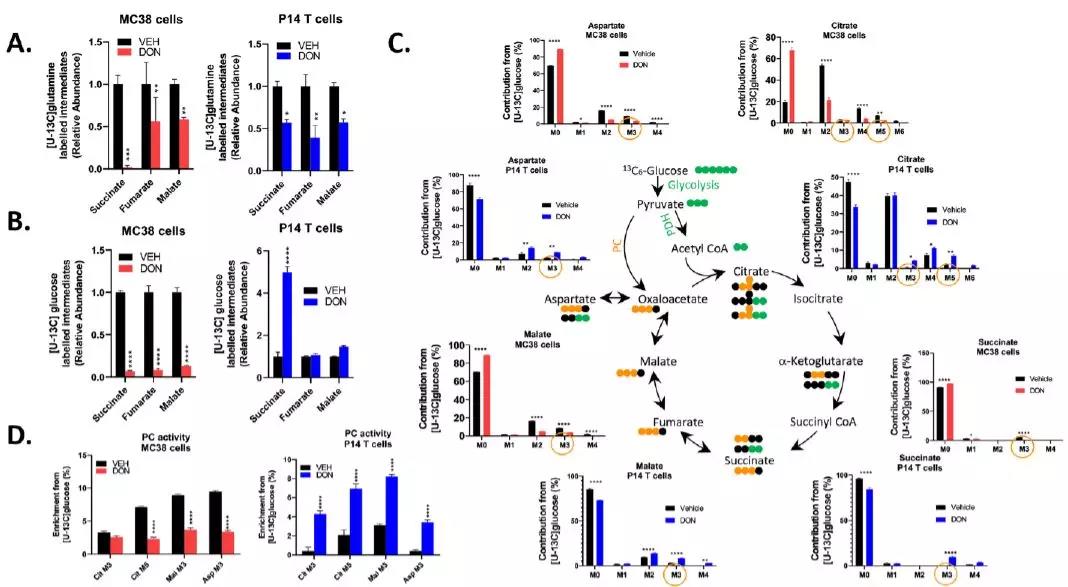
相比之下,DON处理的MC38细胞下调了醋酸代谢酶,并显示在TCA中间产物(图3、H和I)中的13C标记的醋酸结合最少。
因此,在谷氨酰胺阻断期间,乙酰辅酶A的生成在MC38和CD8 T细胞中相互影响。
5. 谷氨酰胺阻断后,CD8+T细胞,通过上调葡萄糖补体来补充TCA中间产物
高度增殖的细胞通常通过谷氨酰胺代谢或谷氨酰胺分解来促进回补,谷氨酰胺分解在TCA循环中通过谷氨酰胺酶(GLS)活性补充α-酮戊二酸。
谷氨酰胺对TCA中间体的贡献在DON处理的T细胞和MC38细胞中被抑制,但丙酮酸生成草酰乙酸酯的丙酮酸羧化酶(PC)会通过葡萄糖补充TCA中间体。
通过稳定同位素示踪研究发现,DON处理的T细胞在葡萄糖代谢方面表现出显著的灵活性,因为它们能够通过PC介导的修复作用上调葡萄糖衍生碳作为乙酰辅酶A和草酰乙酸进入TCA。
因此,DON处理的T细胞(和GLS抑制的MC38细胞)中葡萄糖碳进入TCA循环的模式,包括柠檬酸、苹果酸、天冬氨酸和柠檬酸中M+5同位素增加,表明PC活性增强。
但DON处理的MC38细胞不能为TCA周期提供葡萄糖衍生代谢物或维持Warburg效应,可能是由于DON对这些细胞中近端糖酵解代谢的抑制作用,并且DON处理的MC38癌细胞表现出葡萄糖摄取减少和早期糖酵解中间产物水平降低。
T细胞对DON处理的代谢适应(包括上调的醋酸代谢和PC活性)使它们能够维持细胞的AMP/ATP比率,而MC38细胞无法进行能量补偿,导致AMP/ATP比率显著增加和AMP激酶的强力激活。
文章结论
总之,研究表明,对于癌细胞来说,糖酵解、氧磷和谷氨酰胺代谢之间的相互依赖缺乏可塑性,因此针对谷氨酰胺代谢阻断会导致广泛的代谢抑制、NADP(H)稳态的破坏和生长受阻。相反,在T细胞中抑制谷氨酰胺代谢会导致适应性代谢重编程,从而增强生存,增殖和效应子功能。
转载于: 小迈 迈维代谢





 浙公网安备33010802007965号
浙公网安备33010802007965号