蛋白表达水平和信号通路的异常是肿瘤最常见的特征,近些年来的研究表明,相比于仅通过基因组分析,蛋白组和修饰组包含了更多的基因无法识别的新信息,这一观察引出了蛋白基因组学的概念,综合多组学数据的分析能够更全面的认识肿瘤,也为肿瘤未来的精准治疗提供新的思路和方向。
2019年10月31日,Cell在线发表了题为:Integrated Proteogenomic Characterization of Clear Cell Renal Cell Carcinoma的最新研究成果,来自西奈山伊坎医学院的王培、约翰霍普金斯大学的Hui Zhang和Daniel W. Chan(他们的研究重点是蛋白组学和免疫学技术在诊断、管理以及癌症了解方面的开发及应用)、密歇根大学的Marcin Cieslik和Alexey I. Nesvizhskii 并联合临床蛋白质组肿瘤分析协会(CPTAC),运用系统的蛋白基因组学方法深度揭示肾透明细胞癌病理特征。

肾细胞癌是世界十大常见的癌症之一,其中75%为肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)并占据了肾细胞癌死亡的绝大部分,具有典型的Warburg表型。为了阐明驱动透明细胞肾细胞癌(ccRCC)的功能模块失调,作者对未经处理的ccRCC和配对的正常邻近组织样本进行了全面的基因组、表观基因组、转录组、蛋白质组和磷酸化蛋白质组学表征。基因组分析确定了与基因组不稳定性相关的独特分子亚组,蛋白质组学的整合识别了受基因组改变影响的细胞机制的蛋白质失调:包括氧化磷酸化相关的代谢、蛋白质翻译过程和磷酸化信号模块。为了评估单个肿瘤中的免疫浸润程度,作者还鉴定了微环境细胞特征,该特征描绘了四种以独特的细胞途径为特征的基于免疫的ccRCC亚型。这项研究报告了ccRCC的大规模蛋白质组学分析,以识别基因组改变的功能影响,并为基于ccRCC病理生物学的合理治疗选择提供了证据。
研究速读
1、肿瘤和正常邻近组织标本的蛋白质组学分析
先通过冷冻粉碎法将每个组织均质化并进行分装,使用蛋白质组学方法分析了110个未接受过治疗的RCC和84个配对匹配的NAT样品(样本策略),接着对同一组织样品同时进行了基因组、转录组学分析。蛋白质组学和磷酸化蛋白质组学分析分别鉴定出总共11355种蛋白质和42889种磷酸肽,其中在所有样品中定量了7150种蛋白质和20976种磷酸肽。
为了实现多组学数据集成和蛋白质组学分析,研究对所有110个肿瘤样品进行了全基因组测序(WGS)、全外显子组测序(WES)和总RNA测序(RNA-seq),并且107个肿瘤样品的DNA甲基化数据也被非常完美的获取(组学策略)。除了初步的病理学诊断外,作者还利用了TCGA等提供的可用于RCC的分子信息来进一步验证肿瘤样品的组织学分类。对基因组图谱进行抽样评估,发现了7个ccRCC具有非典型分子畸变的肿瘤,例如在3p上缺乏肿瘤抑制基因的特征性双等位基因缺失。总体而言,检查了来自103个ccRCC和80个NAT组织样品的数据,以进行全面的蛋白质组学表征。
2、CPTAC ccRCC队列的基因组全貌
ccRCC的largeWGS分析,揭示了3p染色体的臂级丢失是最常见的事件(93%),其次是5q染色体增益(54%),14q染色体缺失(42%),7号染色体增益(34 %)和9号染色体丢失(21%)。三种常见RCC亚型的全癌分析和通过肿瘤内异质性方法研究ccRCC肿瘤倍性的研究表明,高基因组非整倍性与不良预后之间存在显著关联,这与作者的研究中鉴定出的基因组不稳定的高级别肿瘤的富集相一致。以前的报告确定染色体易位是ccRCC同时发3p丢失和5q增长的机制,作者的WGS数据得出研究队列中出现的染色体重排的频率和类型。接着,观察到61%的ccRCC病例显示出一个或多个易位事件,主要涉及3p染色体基因座,其中5染色体(20%)、2染色体(11%)和8染色体(7%),还检测了3号染色体内的染色体倒置,导致3q增益和3p丢失同时发生(图1B)。在CPTAC队列中,总共103例ccRCC肿瘤中有102例显示3p失调的证据。PBRM1、BAP1、KDM5C和SETD2的突变率分别为43%、17%、18%和16%(图1C)。作者进一步检查了这些基因的突变和甲基化对其各自的mRNA和蛋白质水平的影响,总体而言,基因组失活事件会导致mRNA和蛋白质表达降低(图1C)。
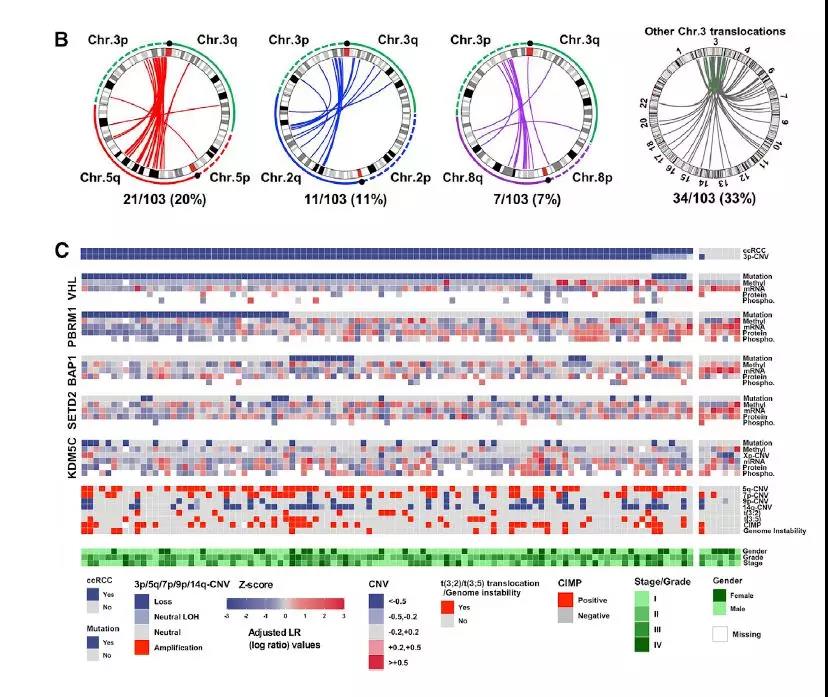
图1、基因组改变及其与mRNA、蛋白和磷酸化蛋白丰度的关系
3、综合蛋白质组学分析基因组的改变
基因组变化能够通过顺式作用影响同位点的mRNA和蛋白质丰度,通过反式作用影响其他位点。对mRNA、蛋白质和磷酸肽的综合分析,鉴定出对转录水平、翻译水平和翻译后水平都有影响的基因组变化,并鉴定出与肿瘤级别相关、癌与非癌组织间差异表达的基因靶点。例如,与PI3K-mTOR信号相关的SQSTM1、OSBPL3、GOLPH3出现拷贝数变异(反式作用);多能转录因子YY1(反式作用)发生突变。对这些基因组变化进行通路分析,3p染色体的丢失与缺氧信号的上调,细胞周期的调节和糖酵解、氧化磷酸化(OXPHOS)的下调、脂肪酸代谢和TCA周期有关;5q的增加导致mTORC1和MYC信号的上调,7p的增加推动蛋白质翻译和上皮间充质转化(EMT)的增加;9p缺失导致肿瘤抑制因子CDKN2A缺失,与翻译起始、m TOR、MYC信号上调有关;14q的缺失涉及潜在的肿瘤抑制因子,14q缺失导致WNT信号表达下调,MYC信号、N-糖基化修饰、IFN- γ信号上调。其中75%的CIMP+肿瘤存在14q缺失,CIMP +肿瘤具有相似的反式作用,包括增加的MYC信号传导和蛋白质翻译,并具有与OXPHOS增加和粘着斑减少相关的独特特征。
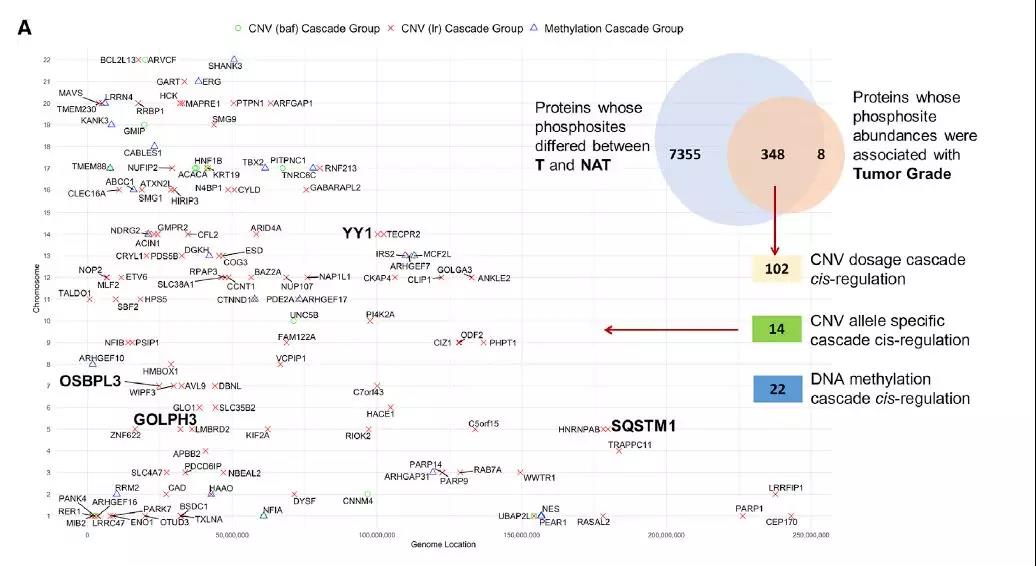
图2、拷贝数变异(CNV)对蛋白质丰度的影响
4、转录组与蛋白质组表达的相关性研究
为了解转录组和蛋白质组学过程之间的调控关系,作者计算了103例ccRCC肿瘤和72例NATs中mRNA 与蛋白的样本间和样本内相关性。NATs的中位基因相关值为0.34,而肿瘤的中位值更高为0.43,这与以往研究结肠直肠癌和高级别浆液性卵巢癌相似(图3A), 在ccRCC和NATs中,分别有74%和52%的mRNA 与蛋白具有显著相关性, OXPHOS、剪接体和核糖体通路在肿瘤中的相关性较差。在NATs中,剪接体和核糖体的内务活动呈现出明显的相关模式,代表了维持细胞内环境稳定的调节轴。样本间的mRNA -蛋白相关性检测显示,肿瘤样本的中位数样本间相关性(0.44)低于NAT样本(0.52),后者的方差更低(图3B) 。如果将高样本相关性与蛋白翻译增加联系起来,不难发现核糖体和翻译因子蛋白表达一致增加;有趣的是,肿瘤中不协调的核糖体蛋白- mRNA水平发生了协同转移。然而,在肿瘤中导致核糖体mRNA和蛋白表达解耦联的调节机制尚不清楚,这表明在评估作为干预ccRCC治疗靶点的核糖体生物发生时,蛋白质证据的重要性。
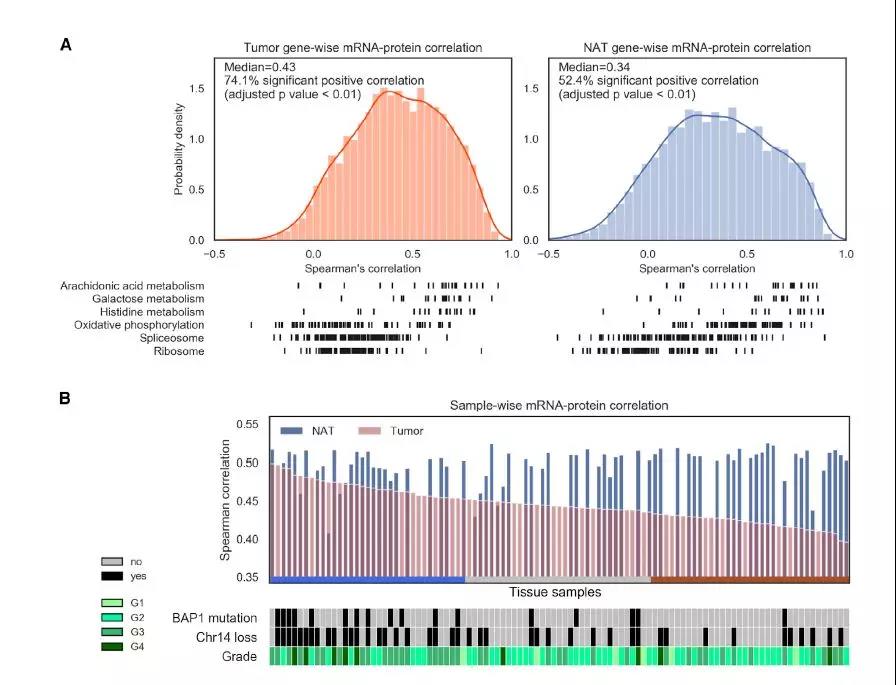
图3、转录组和蛋白质组丰度的相关性
5、ccRCC与NAT相比的蛋白质组学变化
通过主成分分析(PCA)和层次聚类可视化鉴定出的大量蛋白质,可以清楚地区分ccRCC(n = 103)和NAT样品(n = 80)(图4A)。总共820种蛋白质在组织样品的组比较中显示出明显的差异表达,相对于NATs,在ccRCC肿瘤中有565种蛋白质被下调,而255种蛋白质被上调。富集分析显示,肿瘤中的免疫反应、EMT和多种信号通路(缺氧,糖酵解和mTOR)被上调,而TCA周期,脂肪酸代谢和OXPHOS被下调(图4B)。即使考虑到肿瘤和NAT样品中的组织异质性,仍可以维持选择的细胞途径。ccRCC肿瘤的特征在于特殊的基因组改变,已将其分类为代谢疾病,这促使作者鉴定和注释参与细胞代谢的差异丰富的mRNA转录物和蛋白质(图4C)。在此分析中,糖酵解途径中的蛋白质及其同源mRNA均被上调,而与OXPHOS相关的蛋白质则被下调。先前已经观察到ccRCC中代谢mRNA水平与相应的糖酵解和OXPHOS代谢物之间存在非线性相关性。分析肿瘤和NAT之间mRNA和蛋白质水平的差异丰度,发现OXPHOS mRNA和蛋白质表达的显着解偶联与其他细胞途径不同(图4C-4D)。总之,这些结果表明,Warburg效应的功能性后果并未在转录水平上完全被捕获,这可能会影响基于转录的代谢特征在ccRCC预后中的临床应用(Warburg效应与表观遗传,详情请戳:Nature重大突破:全新组蛋白乳酸化修饰调控癌症和炎症等疾病)。
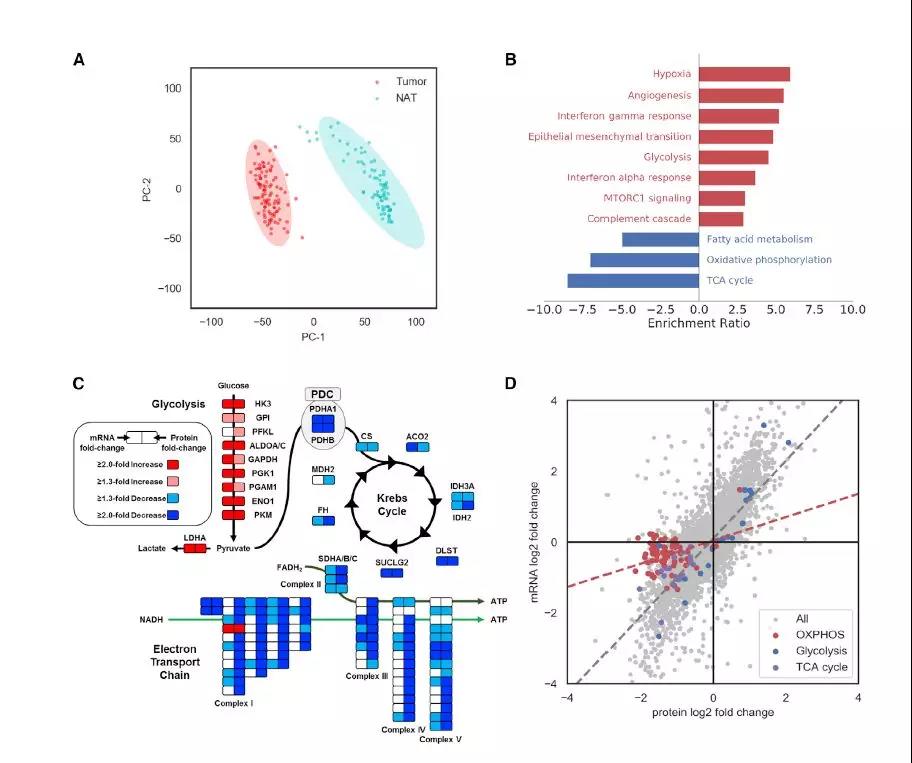
图4 、ccRCC肿瘤和NAT蛋白的差异表达
6、磷酸化蛋白质组学分析激酶和底物调控途径、ccRCC的肿瘤分级
磷酸化影响多个细胞过程,其位点的占据受到其各自底物上激酶和磷酸酶活性的严格控制。作者分析了80个肿瘤/ NAT配对组织之间差异化的磷酸肽丰度,以分层对应于不同激酶及其抑制剂的磷酸底物,并确定CDK1和MAPK1(ERK2)是大多数肿瘤中两个高度排序的磷酸底物事件(图5A)。此外,与S期进入/进展(CDK7-MCM2)和G2/M检查点(WEE1-CDK1)相关的磷酸化底物在大多数肿瘤中升高;几乎所有的肿瘤都上调EGFR(MAPK的上游受体)的蛋白和磷酸肽表达,而对VEGF受体如FLT和KDR则选择性表达。纵向分析所有肿瘤样本中磷酸肽丰度差异,鉴定出几种磷酸肽共表达网络,包括细胞周期和血管生成两个不依赖于整体蛋白质组和转录组变化的模块。此外,作者的磷酸化蛋白质组学分析鉴定了在肿瘤中激活的多种信号转导途径,并为扩大治疗选择范围提供了证据,使其有望超出目前FDA批准的靶向VEGF和mTOR的疗法(图5B)。
肿瘤分级是ccRCC的重要预后指标,通常和肿瘤阶段、肿瘤大小有关。高级别肿瘤中,参与翻译、mTOR信号、EMT等通路的基因在mRNA和蛋白水平均上调,其他细胞通路则在转录组和蛋白组出现非协同性上调,如细胞周期调控和DNA修复的mRNA增加,而OXPHOS和N-糖基化修饰的蛋白增加。低级别的肿瘤表现出受体激酶、RAS、MAPK、Notch、RAP1信号通路等在mRNA和蛋白的增加,同时上调转录相关过程的蛋白表达。
ccRCC根据肿瘤的蛋白组差异被分为3组,ccRCC1:上调适应性免疫、N-糖基化修饰、OXPHOS和脂肪酸代谢相关蛋白,与高级别和晚期肿瘤有关。ccRCC2:肿瘤高表达天然免疫和血小板脱颗粒相关的蛋白。ccRCC3:上调糖酵解、mTOR信号、低氧相关的蛋白。ccRCC2和ccRCC3与较低的肿瘤级别相关,而仅有ccRCC2与肿瘤早期相关。
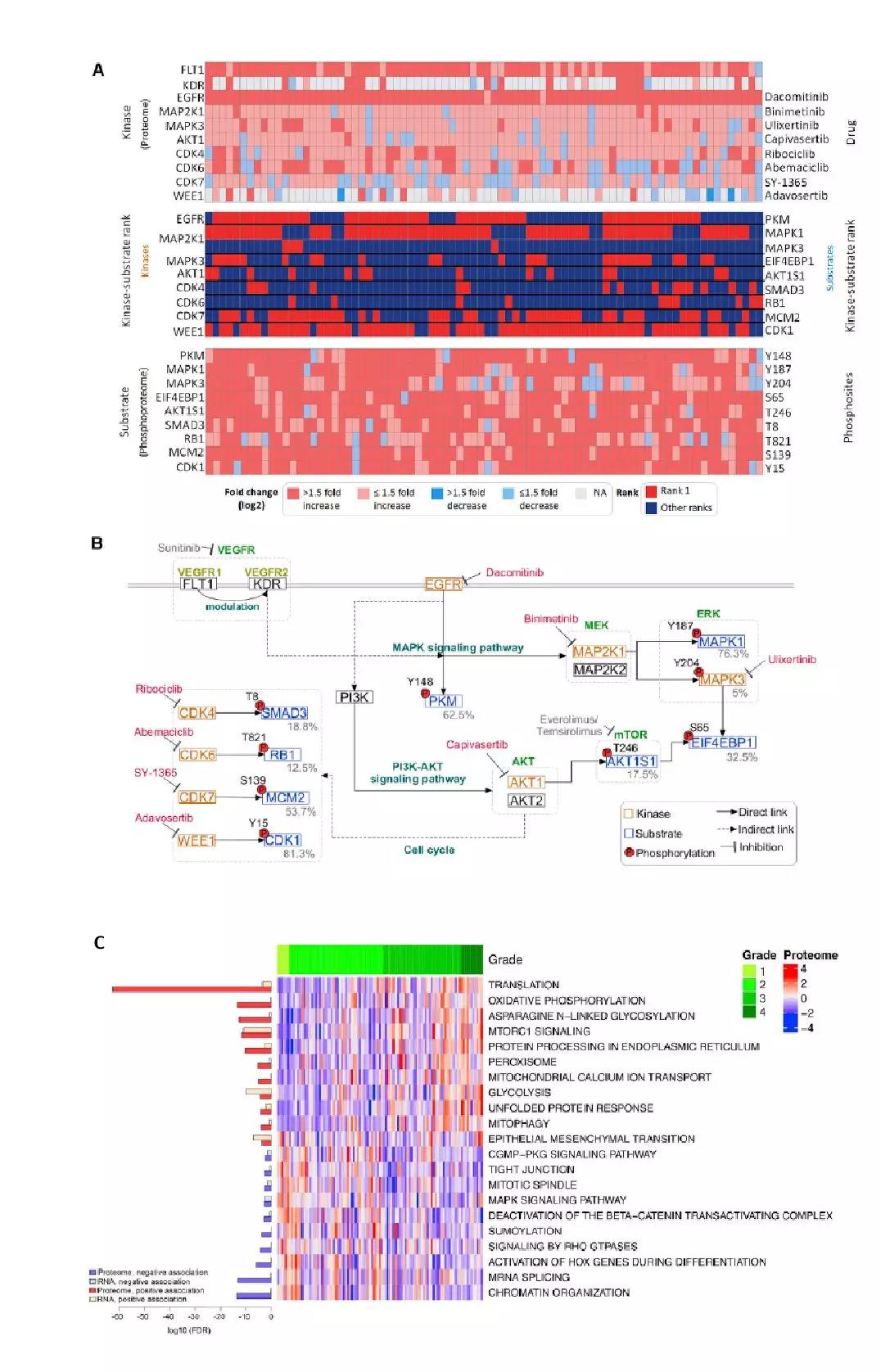
图5、磷酸化蛋白质组学分析与ccRCC肿瘤分级
总的来说,这项研究揭示了独特的生物学见解,提出了只有将互补的蛋白质组学和基因组分析结合起来,才能将基因组畸变的功能性后果与蛋白质组学成果相关联。对肿瘤和相应的NAT进行全面的基因组、表观基因组、转录组学、蛋白质组学和磷酸化蛋白质组学测量的集成,为深入研究ccRCC肿瘤发生提供了宝贵的生物信息资源。作者的多层次“组学”分析可识别在基因组和转录组水平上尚未完全捕获的潜在分子机制,并定义蛋白质组学、磷酸化蛋白质组学和免疫标记是对ccRCC患者进行分层所必需的,终极目标是为了开发合理的治疗性干预措施。
参考文献
Clark, D. J., et al., (2019). Integrated Proteogenomic Characterization of Clear Cell Renal Cell Carcinoma.Cell.
转载于Dr.Proteomics 精准医学与蛋白组学





 浙公网安备33010802007965号
浙公网安备33010802007965号