图片来源:Science
Science:打破传统!癌症基因组中的突变“热点”不一定会推动癌症的生长!
doi:10.1126/science.aaw2872
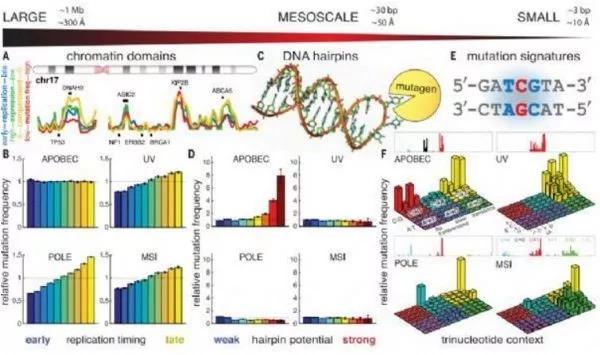
麻省总医院(MGH)癌症中心研究人员的一项研究发现,特定的基因突变经常出现在特定的肿瘤中,但与通常的假设相反的是,这一事实可能并不意味着该突变驱动了癌症的发展和进展。他们发表在《Science》杂志上的文章描述了DNA单链如何以所谓的"发夹"结构折叠起来,对许多癌症中表达的基因编辑酶的突变高度敏感。
但是,这些突变"热点"中的许多发生在与癌症完全无关的基因中,包括基因组的许多非编码区域。
研究者表示,一个典型的癌症基因组会有5到10个驱动突变,以及数千甚至数百万个'乘客'突变。一直以来的想法是,如果在许多不同的癌症患者身上发生了完全相同的突变,那么它一定会给癌细胞带来健康优势,虽然基于复发的识别癌症驱动基因的方法已经成功,但也有可能基因组中的某些位置很容易发生突变。
Cell:非吸烟肺腺癌的基因组重排早在癌症确诊前30年就已存在
doi:10.1016/j.cell.2019.05.013
在一项新的研究中,来自韩国科学技术高级研究院(KAIST)和首尔大学等研究机构的研究人员发现早在童年和青春期发生的灾难性基因组重排可导致非吸烟者在晚年患上肺癌。这一发现发有助于解释一些与非吸烟有关的肺癌是如何产生的,相关研究结果发表在Cell期刊上。
这些研究人员证实非吸烟者体内的基因融合大多较早地发生,有时早在儿童期或青春期,平均而言在肺癌确诊前三十年发生。
这项研究表明,这些携带致癌种子(oncogenic seed)的突变肺细胞几十年来一直处于休眠状态,直到进一步的许多其他突变充分积累才进展为肺癌。这是首次揭示肺腺癌基因组结构变异景观的研究。
肺癌是全球癌症相关死亡的主要原因,肺腺癌是肺癌中最为常见的类型。大多数肺腺癌与长期吸烟有关,但是大约四分之一的肺腺癌在非吸烟者中产生。确切地说,人们对是什么让非吸烟者患上这种癌症仍不清楚。
Nature:揭示病毒基因组如何包装在病毒衣壳内部
doi:10.1038/s41586-019-1229-9
在一项新的研究中,来自芬兰赫尔辛基大学和英国牛津大学等研究机构的研究人员首次破译了病毒基因组如何在病毒衣壳内包装,相关研究结果发表在Nature期刊上。
研究者Juha Huiskonen说道,“这项研究的动机是增加我们对病毒复制的基本认识,但是从长远来看,这可能有助于治疗病毒性疾病。”这一突破性结果是利用低温电镜技术实现的。近年来,低温电镜技术彻底改变了结构生物学,即一个旨在理解生命分子如何在原子水平上发挥作用的生物学领域。
通过使用强大的电子显微镜,这些研究人员拍摄了高纯度病毒的成千上万张图像。这些图像随后经结合在一起形成三维结构模型,从而允许他们不仅能够观察构成病毒衣壳的蛋白,而且还能够首次追踪这种蛋白外壳内的核酸基因组。他们观察到病毒基因组形成一种液态晶体,即一种高度包装和有序的液态物质状态。
Nature:重磅!科学家成功解析出转移性乳腺癌的基因组特性!
doi:10.1038/s41586-019-1056-z
近日,一项刊登在国际杂志Nature上的研究报告中,来自巴塞尔大学等机构的科学家们通过研究成功描述了转移性乳腺癌的基因组特征,相关研究结果或为阐明乳腺癌转移的分子机制及开发新型转移性乳腺癌疗法提供新的思路和研究基础。
转移是引发乳腺癌患者死亡的主要原因,很多研究都分析了乳腺癌早期阶段的基因组特性,然而有研究表明,癌症从早期过渡到晚期阶段会获得许多基因组改变,而且早期乳腺癌的基因组特征或许并不能代表癌症致死性发生的依据。
因此本文研究中,研究人员通过研究分析了617份转移性乳腺癌样本中的体细胞改变图谱,研究者指出,当与来自癌症基因组图谱中的早期乳腺癌样本进行对比后,他们发现,9个驱动基因在表达激素受体但HER2水平并不高的转移性乳腺癌中会频繁发生突变,这些驱动基因包括TP53,ESR1,GATA3,KMT2C,NCOR1,AKT1,NF1,RIC8A和RB1。
Nature:新研究揭示胚胎发育早期基因组的组装特征
doi:10.1038/s41586-019-1233-0
最新一项研究表明,卵母细胞受精后立即会出现DNA活性和非活性区域的分化,该现象甚至在基因被激活之前就已经出现。该研究将有助于更好地了解单个受精卵母细胞发育成由许多不同细胞类型组成的完整生物体的机制。相关结果发表在Nature杂志上。
受精卵最终会发育成一个完整的,由数万亿个具有多种功能的细胞组成的有机体。尽管这些细胞具有不同的功能,但所有这些细胞中的DNA都是相同的。细胞的特性由基因组的特定表达谱决定。但其中的决定机制并不清楚。DNA在细胞核中并不是随机分布的,他们在空间上具有活性和非活性区域的区分。不同的区域则由被称为Lamina Associated Domains,或LAD的结构分隔。

图片来源:CC0 Public Domain
Cell:科学家鉴别出维持细胞基因组完整性的新型DNA修复机制
doi:10.1016/j.cell.2018.10.055
日前,一项刊登在国际杂志Cell上的研究报告中,来自范德堡大学的科学家们通过研究鉴别出了保持基因组完整性的新型DNA修复机制。研究者表示,这种机制是由一种名为HMCES的蛋白质所开启的,HMCES是此前研究者所鉴别出的200多种蛋白质家族的一种,这些蛋白质属于特殊分子机器的一员,其能在细胞分裂时帮助DNA进行复制。其中有些蛋白质是用于与DNA复制相关的功能,而包括HMCES在内的一些蛋白质则并未发现该功能。
研究者Cortez说道,每一种有机体中都有HMCES样的蛋白质,比如人类、细菌等;这项研究中我们剔除了细胞中的HMCES基因来寻找细胞复制中的问题,但研究者并未发现任何问题,即缺失HMCES的细胞依然能够正常进行分裂和DNA复制;当研究者利用损伤的DNA来挑战这些细胞时他们发现,HMCES对于维持细胞健康至关重要。
Cell:发现一种将癌症进展与基因组不稳定性关联在一起的新型生物标志物
doi:10.1016/j.cell.2018.11.024
我们的DNA经常受到攻击。这种含有我们的遗传信息的分子极易受到从环境因素(如辐射)到我们呼吸的空气和我们吃的食物中的化学物的一切东西的影响。基因组不稳定性可导致遗传疾病、慢性疾病和癌症易感性。
在一项新的研究中,来自以色列特拉维夫大学的研究人员确定一种称为ubiquilin-4的蛋白水平升高成为基因组不稳定性的一种新的生物标志物。他们发现ubiquilin-4参与保护基因组免受DNA损伤,但是过多的ubiquilin-4是有害的。
当ubiquilin-4在肿瘤细胞中的水平增加时,这些肿瘤细胞更容易发生基因组不稳定性,从而加速肿瘤进展并让它抵抗常用的癌症治疗,相关研究结果近期发表在Cell期刊上。
Nature:改写教科书!中国科学家阐明保护卵母细胞独特表观基因组的新型机制!
doi:10.1038/s41586-018-0751-5
在哺乳动物中,雌性机体的卵母细胞数量往往有限,卵母细胞拥有一套独特的表观基因组,其甲基化程度相当于精子的一半,而且卵母细胞也是一种分化程度最高的体细胞;截至目前为止,研究人员并不清楚这种独特的DNA甲基化的调控模式以及其相关的功能。
近日,一项刊登在国际杂志Nature上的研究报告中,来自中国科学院生物物理研究所朱冰教授的研究团队通过研究就鉴别出了一种新型的DNA甲基化调节子—Stella,其在体细胞中的异位过量表达会通过干扰DNA甲基化调节子UHRF1的功能来诱发全面的DNA去甲基化作用。
文章中,研究者揭示了Stella如何通过一种活性的核输出过程将调节子UHRF1从细胞核隔绝,而Stella缺失所引发的UHRF1功能失调会导致卵子发生期间异常DNA甲基化的积累,相关研究发现揭示了首个调节性因子能够保护卵母细胞基因组特殊的甲基化状态。
Cell:挑战常规!真核生物基因组周期性竟由突变导致
doi:10.1016/j.cell.2018.10.004
在一项新的研究中,来自西班牙巴塞罗那生物医学研究所(IRB Barcelona)的研究人员通过研究突变在3000多种人类肿瘤样品中的分布,观察到这些突变也每隔10个DNA碱基对积累一次,相关研究结果发表在Cell期刊上。
研究者Oriol Pich解释道,“通过研究突变在不受自然选择影响的基因组区域中的分布,我们发现在形成核小体的一部分的DNA中存在着显著的每隔10个碱基对的周期性。”突变周期性的产生是因为包装在核小体内部的DNA的结构有利于易于损伤和修复的区域的出现。因此,这些区域更容易发生突变。
接下来,这些研究人员将注意力转向人类和植物中的从一代传递到另一代的突变。他们发现这些遗传性突变也每隔10个碱基对积累一次。鉴于这个关于核小体如何影响DNA突变的新发现,这些研究人员推断它还可能解释真核基因组序列中这种神秘的周期性的产生。
Cell:华大基因主导的最大规模中国人基因组测序结果揭示独特的病毒感染模式
doi:10.1016/j.cell.2018.08.016
在一项新的研究中,通过分析全球最大的涉及141431名来自中国各地的孕妇的基因组数据,来自中国深圳华大基因等研究机构的研究人员发现了基因与出生结果(包括双胎妊娠和女性第一次怀孕时的年龄)之间存在意想不到的关联。这种分析还允许这些研究人员重建中国不同种族群体在近代的人口流动和通婚,并有望有助于鉴定出让人们容易患上传染病的基因,相关研究结果发表在Cell期刊上。
这些孕妇提供了血液样本来测试胎儿染色体异常,主要是唐氏综合症。这种称为无细胞胎儿DNA测试的技术是一种非侵入性产前测试方法。鉴于孕妇的血液中漂浮着来自她们未出生的孩子的DNA,这种技术是可行的。通过快速鸟枪测序,实验室能够让血液中所有自由漂浮的DNA发生断裂,并对大小刚好的DNA片段进行测序以便诊断唐氏综合症。
转载于生物谷





 浙公网安备33010802007965号
浙公网安备33010802007965号