2017年Jeffrey C. Hall, Michael Rosbash , Machael W. Young三位美国遗传学家因在昼夜节律(也称生物钟)分子调控机制研究中取得突破性进展而荣获诺贝尔生理学或医学奖,他们的研究揭示了植物、动物及人类如何调节自身生物节律。时隔一年,Jerzy Adamski教授及其研究团队在Cell上发表《Atlas of Circadian Metabolism Reveals System-wide Coordination and Communication between Clocks 》论文,采用代谢组学技术研究不同组织的昼夜节律代谢物轮廓进而揭示了生物钟之间的协调和通讯。
大量流行病学和动物研究证据指出昼夜节律在个体健康层面的重要性。昼夜节律允许细胞和组织在精确的时间和空间内划分代谢途径,特定的代谢途径是生物钟的关键调节因子,机体代谢物随生物钟波动从而调节转录和染色质可及性。代谢物是生物钟和新陈代谢之间的重要媒介,通常作为替代诊断和预测生物标志物来界定机体的健康或病理学状态。在能量平衡条件下不同组织的生物钟可以精确同步并维持机体稳态,而组织间平衡的破坏会增加代谢性疾病的风险,可见机体代谢和生物钟是密不可分的。
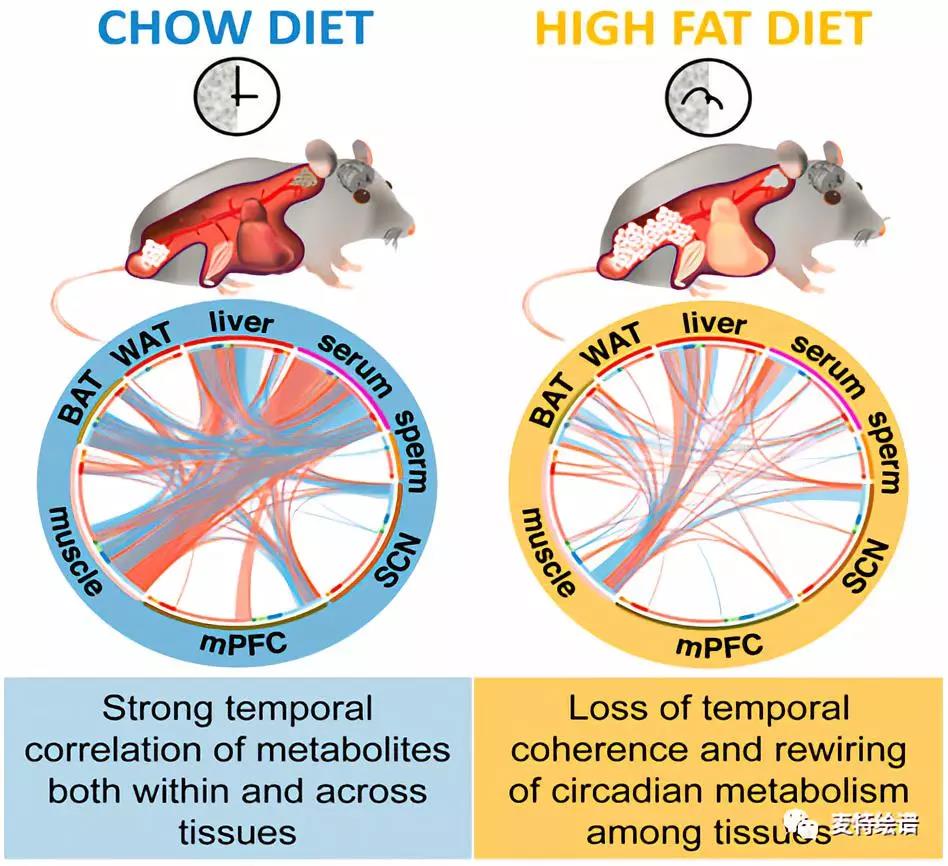
Jerzy Adamski研究团队以正常饮食(Chow)和高脂饮食(HFD)喂养C57BL/6J小鼠10周后,每4小时收集小鼠8个部位的生物样本:视交叉上核(SCN)、内侧前额叶皮质(mPFC)、腓肠肌、肩胛间棕色脂肪组织(BAT)、附睾白色脂肪组织(WAT)、肝脏、血清和附睾尾部精子(Fig.1A),采用液相色谱-质谱(LC-MS)和气相色谱-质谱 (GC-MS) 联用技术对(ZeitgeberTime, ZT) 0h, 4h, 8h, 12h, 16h, 20h, 24h七个时间点收集的生物样本进行代谢组学全谱分析,每个组织中检测涵盖系列代谢物类别的数百种代谢物(Fig.1B, 1C),并绘制出24小时代谢动态图。
时间和组织特异性代谢物分析
代谢物数量、时间波动和HFD对代谢影响存在组织特异性差异(Fig.1B),不同组织的代谢物类别基本相似(Fig.1C),相对代谢物丰度则体现了组织成分不同(Fig.1D):WAT和BAT以脂质为主;脑和肌肉主要为氨基酸和脂质;肝脏和血清主要为碳水化合物、氨基酸、脂类和能量代谢物; 精子则主要包含脂质和能量代谢物。HFD的影响因组织而异(Fig.1C, 1E),在mPFC和腓肠肌中检测到约540种代谢物(腓肠肌和mPFC分别有232, 75个代谢物因HFD出现显著变化),受HFD影响最大的是WAT、肝脏、BAT、腓肠肌和血清,大约40%-60%的代谢物出现显著改变(Tab. 1),SCN、mPFC和精子则分别仅有27%, 14%和8%的代谢物发生改变。通路富集分析筛选出由HFD改变的特定脂质类别,包括长链脂肪酸、多不饱和脂肪酸(PUFA)、二酰基甘油、磷脂、鞘脂、甘油脂和溶血脂。代谢物参与氨基酸代谢,精氨酸、脯氨酸、赖氨酸、支链氨基酸(BCAA)、二肽都受到高度影响。代谢物丰度的改变显示组织病理学特征(Fig.1F),在Chow组中碳水化合物占肝脏代谢物的53%,而仅有8%碳水化合物受HFD发生显著改变;Chow组中脂质仅占11%,而HFD改变了52%的脂质(Fig. 1D),表明肝脏脂肪变性。在HFD组中腓肠肌检测到大量脂质,已知其会对胰岛素敏感性产生负面影响。
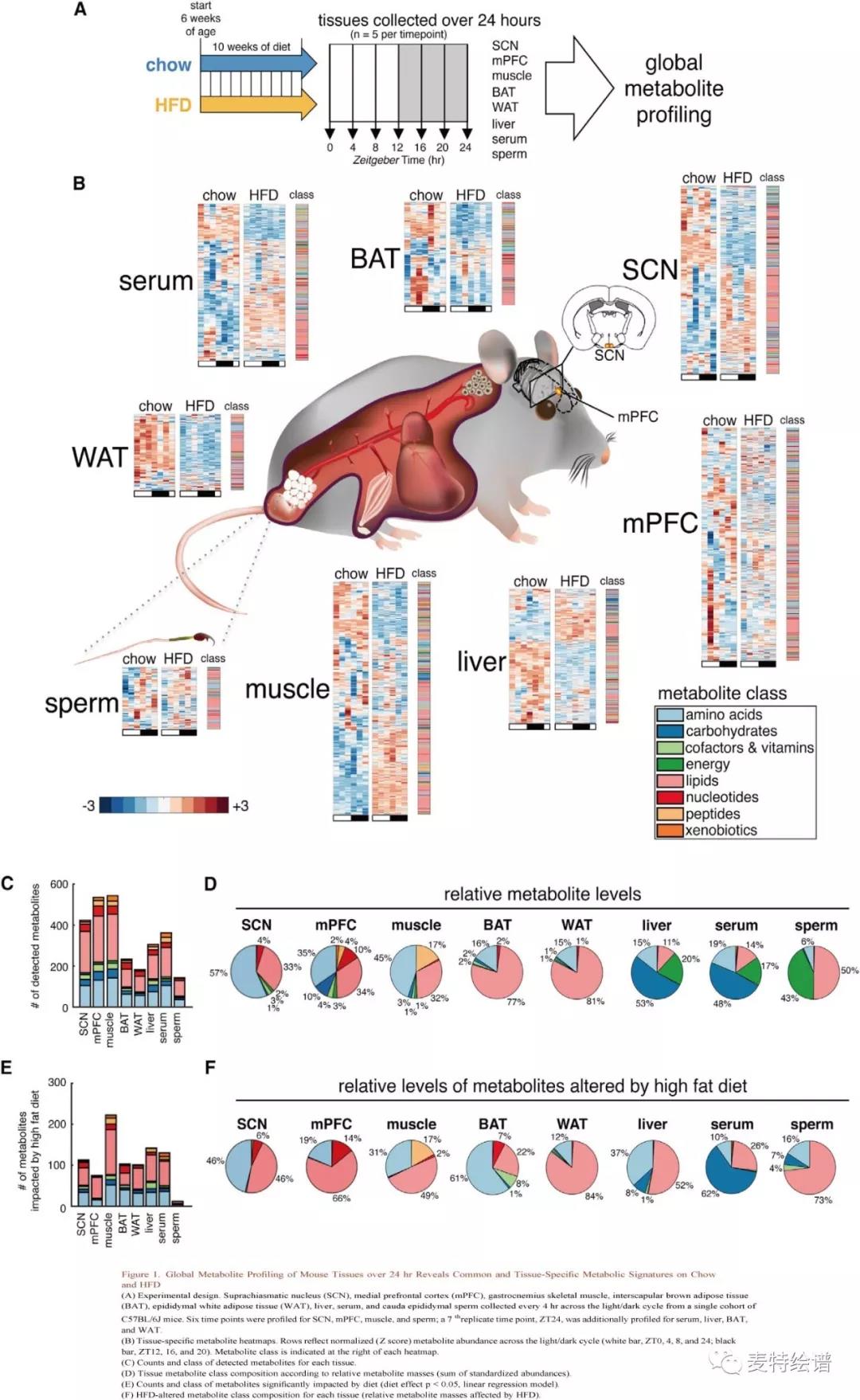
IG. 1 24小时内小鼠组织的全谱代谢物组分析
HFD对24小时代谢的组织特异性影响
比较昼夜节律代谢物揭示了不同组织24小时代谢的差异性。血清、BAT、肝脏、骨骼肌和mPFC都是代谢高度活跃的组织(Fig.2),无论饮食如何,都有20%-50%的代谢物显现出24小时内的节律波动。脂质是每种组织中检测到最多的一类(Fig.1C),而两种不同饮食的组织中循环脂质数量差异较大(Fig.2),Chow组BAT、mPFC和血清比SCN、肌肉、WAT和肝脏检测到更多的循环脂质,但HFD组BAT、mPFC和血清未见脂质节律波动,SCN却可见100个重新波动的脂质。Chow组BAT、mPFC和血清中24h循环脂质到白昼期有着显著的时间门控,每种组织的峰值略有不同,脂质分别在mPFC(ZT-6)、血清(ZT6-ZT8)和BAT(ZT8-ZT10)达到峰值。Chow组骨骼肌在24小时循环代谢物峰的分布上更具多样性和暂时性,碳水化合物、核苷酸、氨基酸分别在ZT2、ZT8、ZT18达到峰值。HFD组氨基酸峰值在ZT8-ZT10附近,ZT20处出现次级峰,可见HFD组肌肉氨基酸代谢大量重组。与疾病相关的代谢物富集体现了与“骨骼肌退化”的关联,凸显了潜在的病理学基础。昼夜代谢物富集揭示了常见的和组织特异性的代谢物类别。确实,慢性HFD会导致腓肠肌萎缩,而血清和肌肉的BCAA代谢物维持稳健的24小时波动却不依赖于饮食,而在HFD组血清和肌肉还观察到甘氨酸、丝氨酸和苏氨酸代谢物的昼夜节律富集。在HFD组,肌肉组织可见丙氨酸和天冬氨酸代谢相关代谢物的24小时波动,而BAT中含有鸟嘌呤的嘌呤核苷酸出现波动。
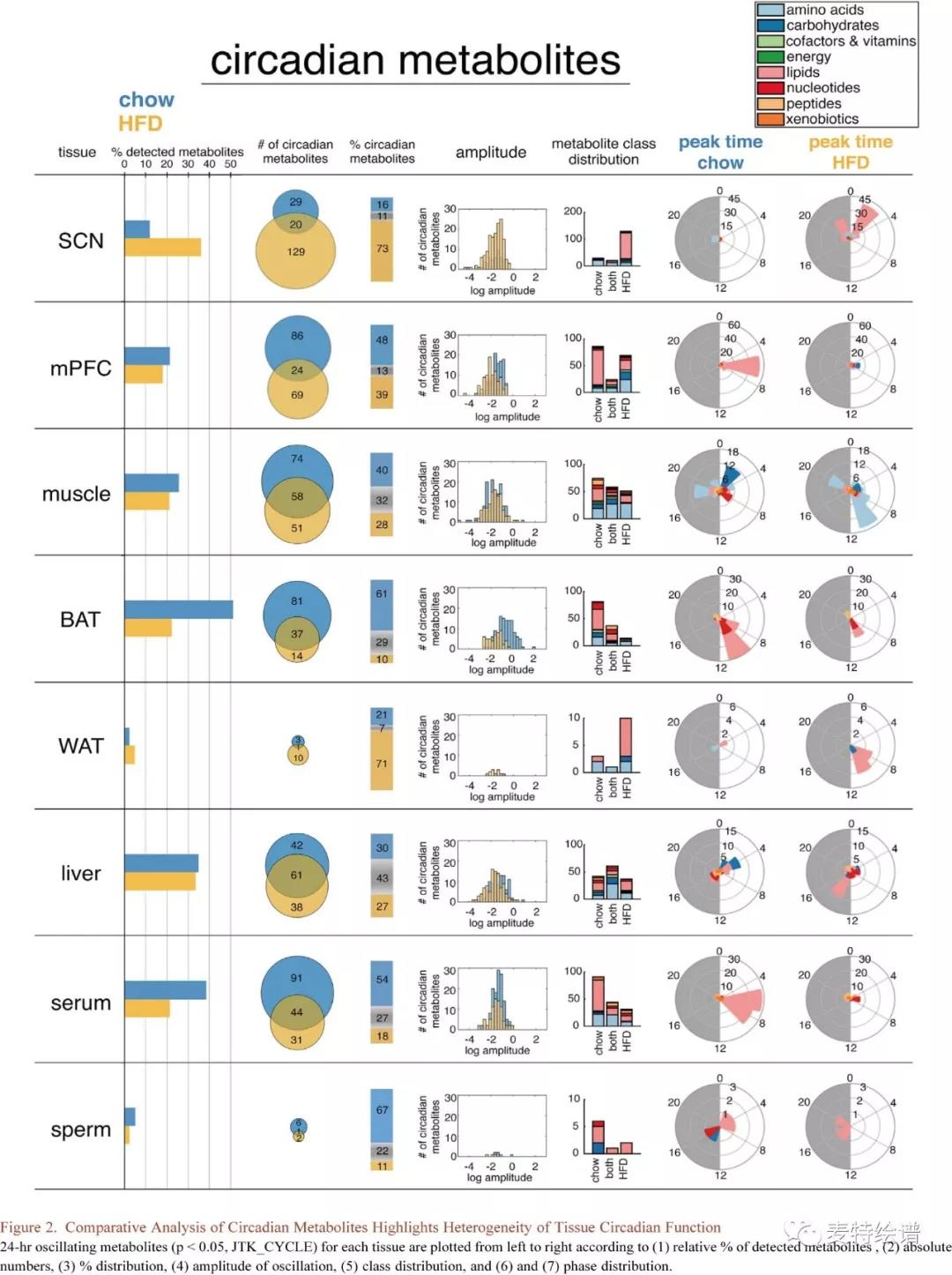
FIG.2 昼夜节律代谢物的比较分析
代谢物相关性显示代谢途径的组织特异性时间门控
代谢通路时间门控的连贯性对于维持组织稳态是必需的,代谢物的时间相关性可以作为组织内单个细胞同步的一般指标,因为动态通路在同步细胞之间应该是高度相关的。在所有组织中代谢物之间存在广泛的正\负时间相关性(Fig.3A和Fig.3B),有趣的是HFD组中许多组织丧失了代谢物相关性,HFD组血清、BAT、肝脏和肌肉分别损失98%, 74%, 34%和39%,表明肝脏和肌肉中代谢途径出现维持或重组,血清中代谢物相关性的严重丧失对营养干预如何加剧组织间的失调有重大影响。根据代谢物类之间或之内的正/负时间相关性进行可视化(Fig.3C),血清脂质与氨基酸显示出最强的时间相关性,而在HFD组这一相关性显著降低。 HFD组BAT中核苷酸、脂质和氨基酸之间正相关性丢失。HFD组中肌肉和肝脏同样丧失了代谢物类别之间的时间相关性,但其维持了包括氨基酸和碳水化合物之内的大量代谢物相关性,比如肌肉糖酵解中间体和肝糖代谢物保持时间相关性。HFD血清中除了几种中链脂肪酸和溶血脂质外,必需脂肪酸失去相关性,而肌肉在酰基肉碱和三羧酸(TCA或Krebs)循环代谢物之间失去相关性。HFD血清和肌肉中BCAA和其他氨基酸之间的相关性,表明组织间存在协调反应。
采用时间关联可以重建24小时内的代谢途径。例如,肌肉糖酵解中间体和酰基肉碱分别反应细胞质或线粒体ATP产生情况,两类代谢物都显示出24小时动态波动(Fig.3D)。Chow组代谢物在不同时间窗口出现峰值可以反映昼夜变化规律,糖酵解中间体在白昼期下降,而酰基肉碱增加。当糖酵解中间体在夜间增加时,酰基肉碱则降到最低。HFD组糖酵解中间体在黑暗期被钝化,而酰基肉碱仍保持在峰值水平,这些代谢物协同改变意味着代谢适应性受损并可能诱导胰岛素抵抗。
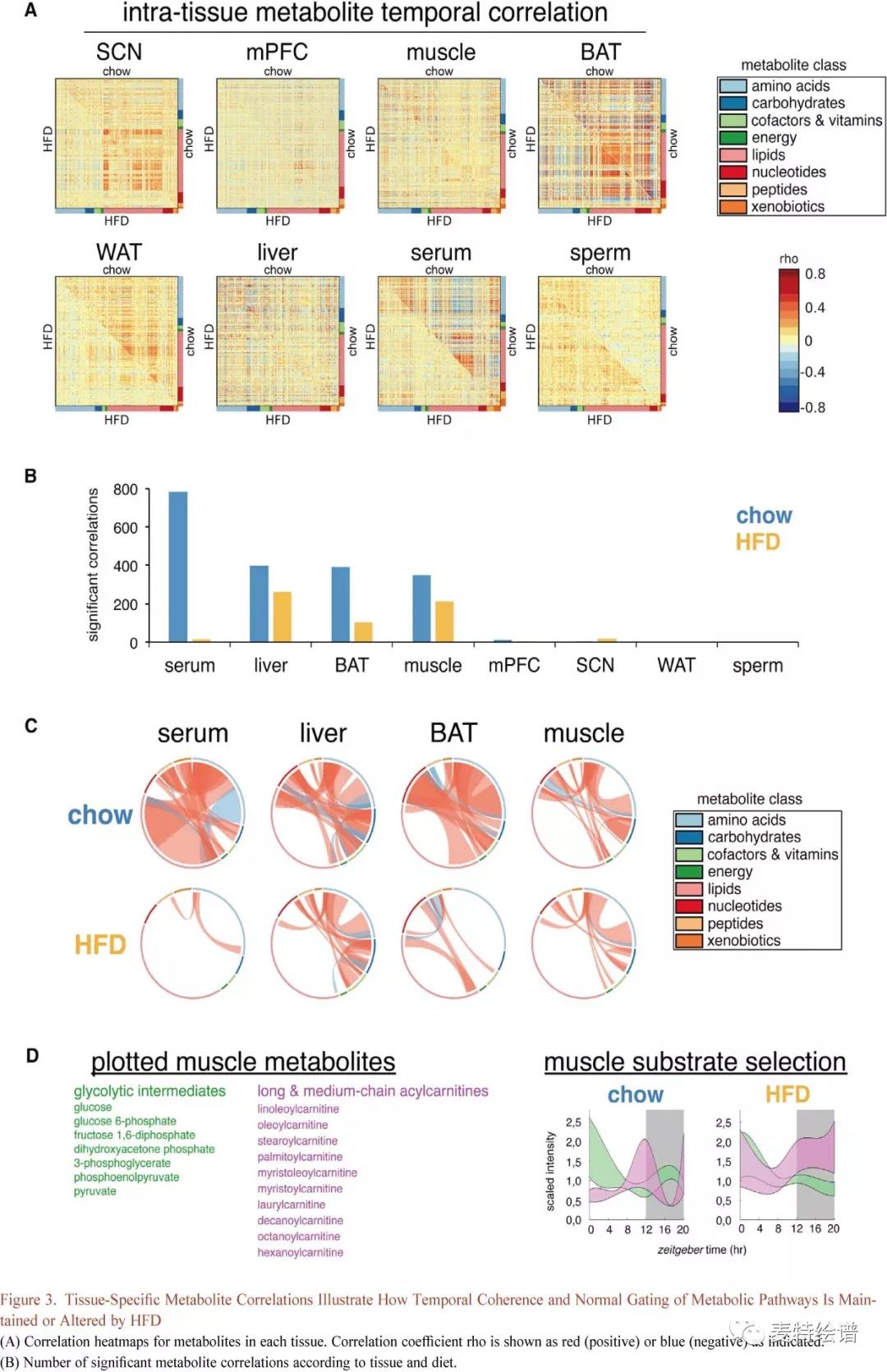
FIG.3 组织特异性代谢物相关性
组织间时钟通讯:代谢物的协调与失调
组织间代谢物时间相关性图揭示了组织间的代谢偶联(Fig.4A)。血清成为Chow组代谢物相关性的主要来源,强调了时间通讯中血清循环代谢物的作用,因为血清代谢物可指导和反映组织特异性代谢。HFD组血清、肌肉、肝脏和BAT代谢物时间连贯性出现严重丧失(Fig.4B, 4C),比较其跨组织相关性凸显了HFD引起的代谢物相关性的丧失与重组(Fig. 5)。肝脏-血清与肌肉-血清代谢物相关性在HFD上降低了约60%,而BAT-血清相关性减少了74%。Chow组中血清和其他组织之间相关的主要代谢物类别是脂质和氨基酸(占60%-70%),BAT和血清中的核苷酸显示出相对较高的时间相关性。HFD组大多数跨组织代谢物相关性丢失,组织间脂质损失约80%,氨基酸损失35%-66%。大多数HFD组织间代谢物相关性在Chow组没有重现,这些新出现的相关性在肌肉、血清和肝脏氨基酸中尤为普遍,再次突出了连接这些组织的协调代谢反应。
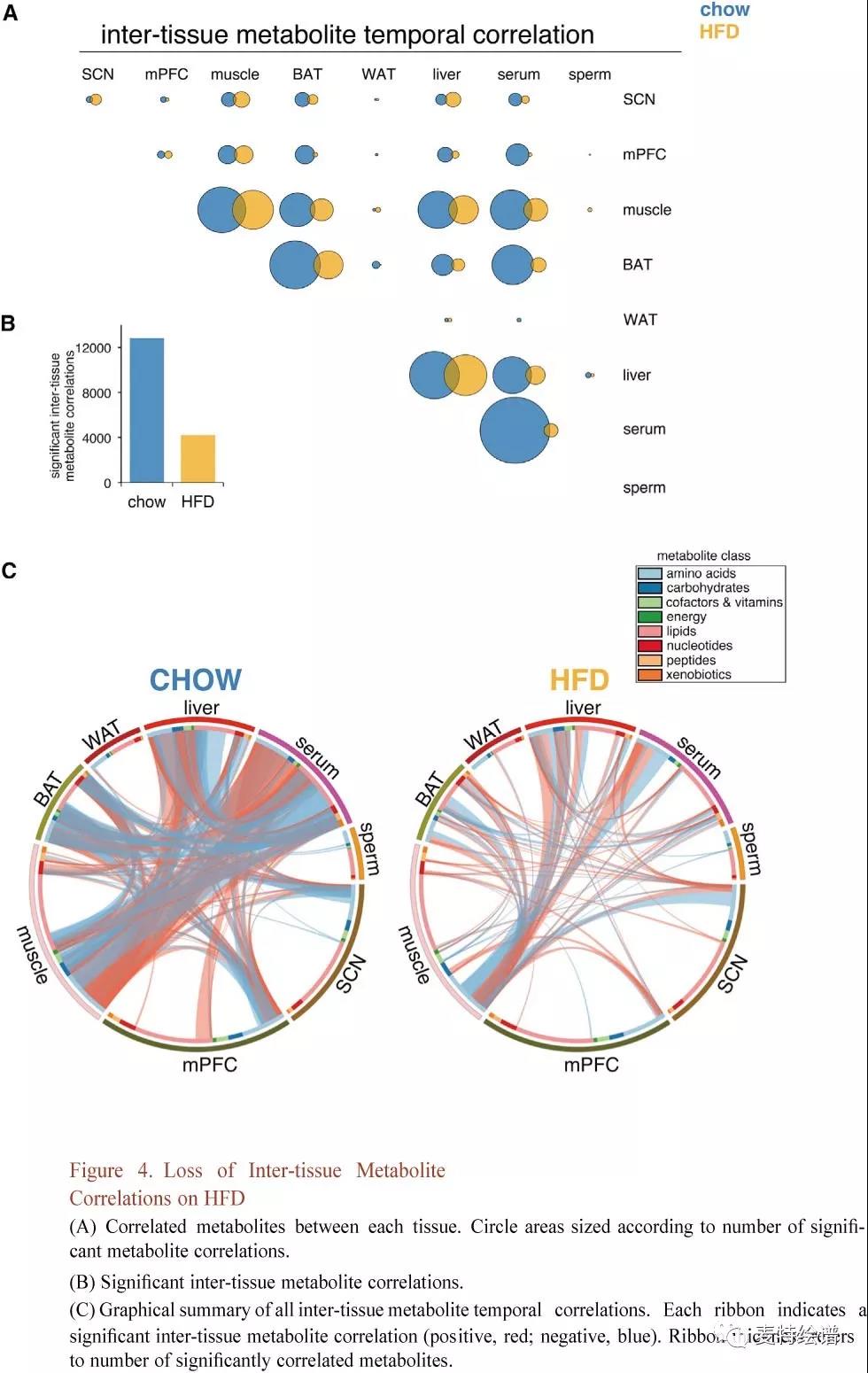
FIG. 4 HFD组织间代谢物相关性的丧失
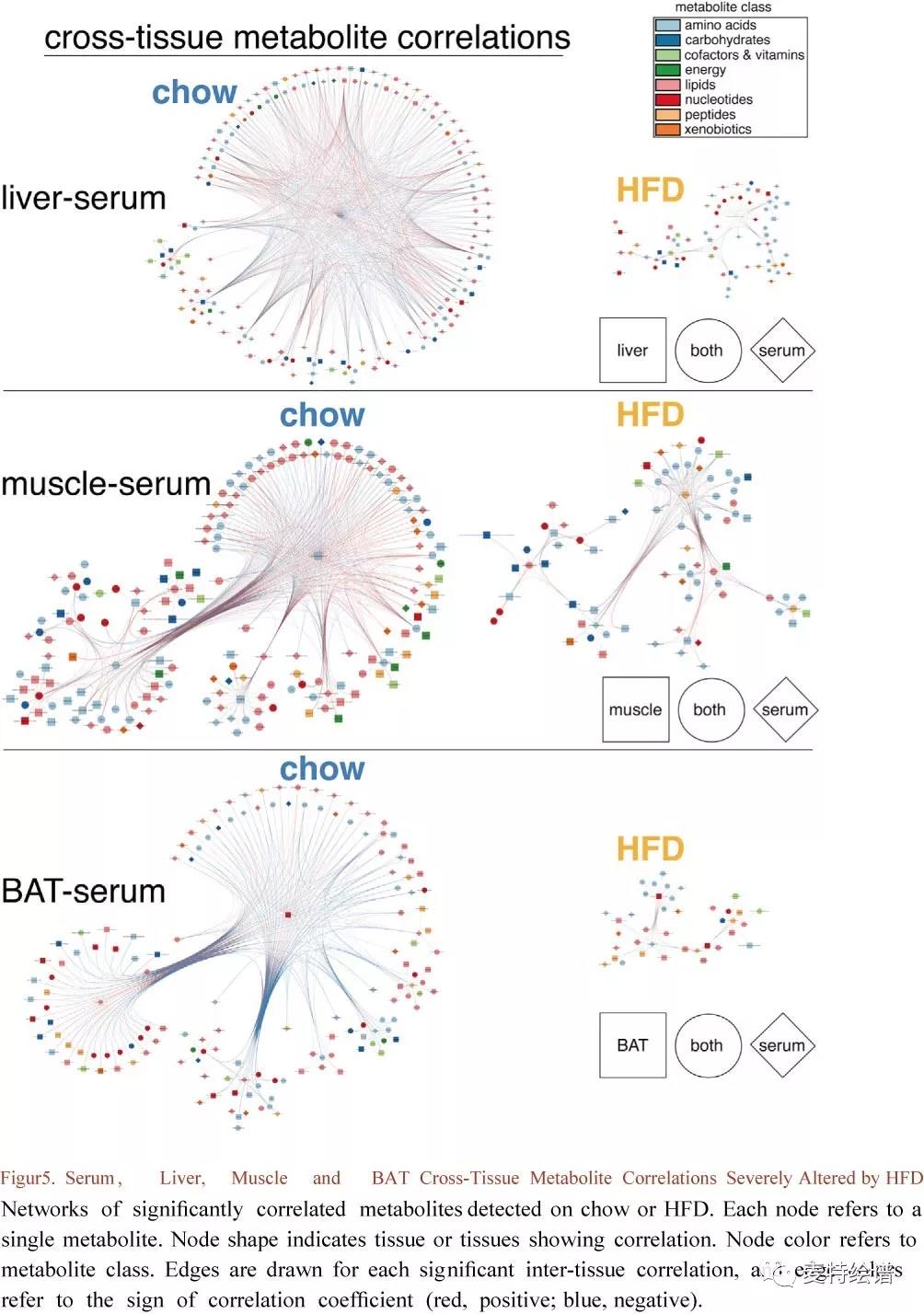
FIG. 5 血清、肝脏、肌肉和BAT交叉组织代谢物相关性
HFD增加肌肉蛋白代谢与肝脏葡萄糖和甘油生成增加有关
本研究数据揭示了显著的HFD特异性代谢物相关性和重新波动,肌肉蛋白降解的增加与肝脏葡萄糖和甘油生成相关。如Fig.6所示,Chow组肌肉、肝脏谷氨酰胺和丙氨酸的昼夜节律被门控到不同的时间窗口,Chow组循环丙氨酸在整个昼夜周期中相对稳定,但HFD组变得高度起伏并且在白昼期间增加,这种效应在HFD组骨骼肌更加明显,丙氨酸在白昼期间升高。而HFD组肝脏或WAT中丙氨酸变化并不明显,BAT中略微降低。骨骼肌中丙氨酸产生和释放的增加通常是对饥饿期间蛋白质分解增加的反应。肌肉蛋白质降解的速度临床上常通过3-甲基组氨酸来推断,本研究仅在Chow和HFD组血清和骨骼肌中检测到3-甲基组氨酸且都表现出24小时波动,HFD组3-甲基组氨酸峰值显著增加,表明肌肉蛋白质降解增加。
甘油3-磷酸是甘油酯-甘油和极低密度脂蛋白合成的主要前体,其在HFD组昼/夜循环中增加了约50%(Fig. 6C),并且与肌肉和血清中的丙氨酸波动一致,表明血清丙氨酸转化为肝脏甘油三酯。时间上相关的肌肉和血清3-甲基组氨酸的上升和下降很大程度上反映了内源性血清皮质酮和胰岛素的24小时波动(Fig. 6D)。研究结果表明慢性HFD可局部增强对内源性糖皮质激素的敏感性,事实上,HFD组血清葡萄糖仍保持在较高水平,而小鼠肝脏和肌肉中的葡萄糖变化被削弱的同时又有升高并在ZT12达峰(Fig.6E),与内源性糖皮质激素的峰值相对应(Fig.6E)。Fig.6F总结了HFD组肌肉,血清和肝脏代谢物之间的致病关系,结果表明肌肉蛋白质周转,尤其是肌肉丙氨酸的产生和释放,在代谢疾病中具有过去未曾认识到的致病性。
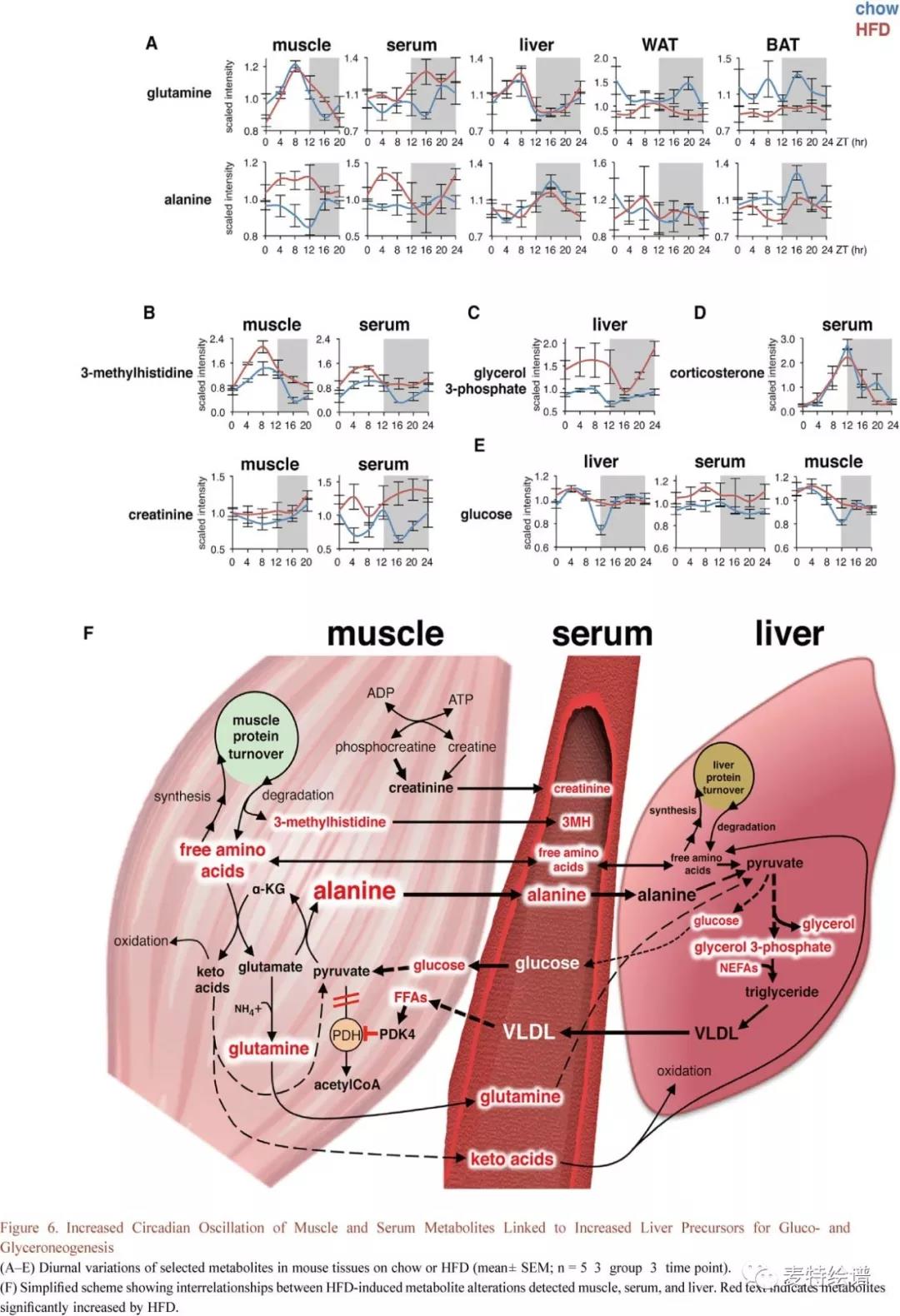
FIG.6 增加肌肉和血清代谢物的昼夜节律波动与肝脏葡萄糖和甘油生成增加有关
HFD组BAT中嘌呤核苷酸的波动与UCP1活性受损相关
甘油和非酯化脂肪酸(NEFA)的组织特异性变化反映了组织间持续的脂质更新和运输处于动态平衡中,即在组织内和组织间发生高速率的脂质降解、相互转化和再酯化,而总体脂肪含量保持恒定。HFD减缓了循环NEFAs的波动,增加了血清甘油的水平,并且WAT和BAT中的NEFA水平和波动严重降低(Fig. 7A),表明两个脂肪库中脂质储存的昼夜转换受损。昼夜节律BAT中 NEFA的大量减少归因于解偶联蛋白-1(UCP1)激活直接刺激产热质子泄漏。在活化脂肪酸缺乏的情况下,线粒体外嘌呤核苷酸通过直接结合和抑制解偶联蛋白1(UCP1)来恢复BAT线粒体的能量守恒。同时5’-GMP(鸟苷一磷酸)及其前体鸟苷均在HFD上获得了新的波动,且在白昼期出现大幅增加并于ZT8达到峰值(Fig. 7B, 7C)。BAT含有高水平的GMP还原酶(GMPr),其催化鸟嘌呤核苷酸还原为肌苷一磷酸(IMP),从而通过释放具有内源性抑制性的核苷酸来促进UCP1活化。IMP可以进一步转化为AMP并去磷酸化形成腺苷,其是棕色脂肪细胞活化剂。与增加的5’-GMP一致,IMP, AMP和腺苷在来自HFD小鼠的BAT中均增加,随着昼夜节律的变化而逐渐减少,这取决于它们与GMP的代谢邻近(Fig. 7B, 7C)。
嘌呤核苷酸的细胞内浓度常通过连续的相互转化和分解代谢来维持(Fig. 7D)。在HFD组BAT中NAD+24小时波动被消除,NAD+处于组成型低水平(Fig. 7E),表明HFD的BAT嘌呤核苷酸分解代谢受损。NAD+在线粒体和细胞核池中提供代谢调节。类似地,由SIRT3脱乙酰酶催化产生及又可通过烟酰胺磷酸核糖转移酶(NAMPT)催化作为NAD+补救前体的烟酰胺(NAM)也在HFD组失去波动(Fig. 7E)。HFD诱导的BAT时钟功能减退可能直接损害Sirt3和Nampt基因表达,Nampt在白昼期表达适度降低,而Sirt3在黑暗期显著增加。 HFD组BAT中24小时代谢物谱的变化反映了与时钟中断和错位有关的功能缺陷。为了研究GMP和IMP在驱动质子泄漏抑制中的作用,作者利用HEK293细胞(人胚胎肾细胞)分离出线粒体(可异位表达小鼠UCP1)。添加嘌呤GDP,GMP或IMP对正常HEK293细胞呼吸作用驱动的质子泄漏并没有影响(Fig. 7G)。然而在UCP1存在时,质子泄露动力学向上移动,显示了解偶联作用的增强,在添加GDP或GMP后,这种情况被阻止了。在最常见的膜电位下,添加GDP或GMP可引起含UCP-1线粒体产生相似的质子传导性降低,而添加IMP对呼吸速率或膜电位并没有影响。这表明了鸟嘌呤部分对UCP-1抑制的重要性。总之本研究数据表明HFD组BAT中GMP增加在生理上和严重受损的质子泄露是相关的且可能是足够的,特别是在HFD的脂肪酸水平大幅降低的情况下(Fig.7A)。 这将严重降低BAT对全身能量支出的贡献,促进脂质的积累。
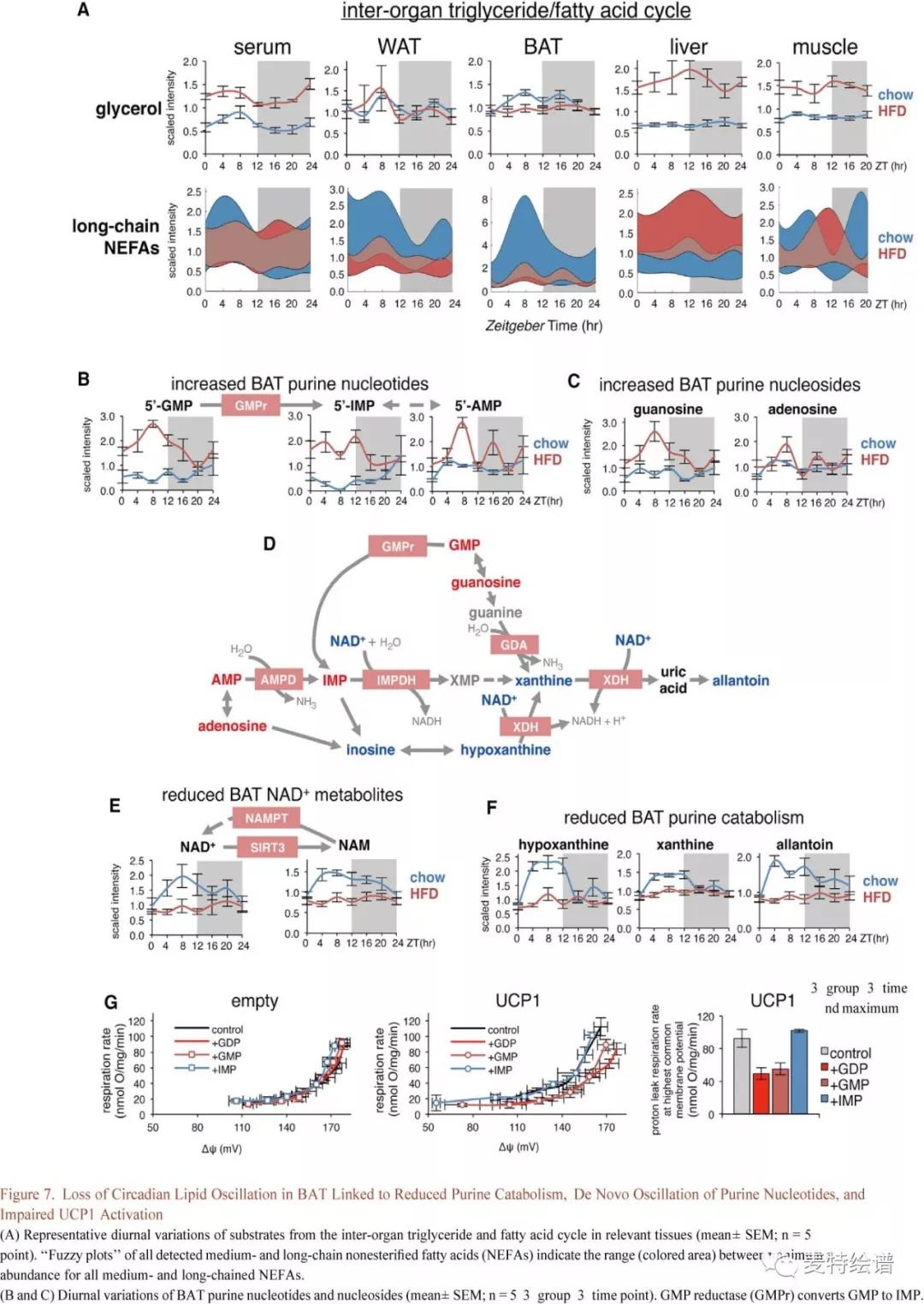
FIG.7 BAT中昼夜节律性脂质波动的丧失与嘌呤分解代谢减少,嘌呤核苷酸的重新波动和UCP1激活受损有关
小结
代谢疾病通常以不同组织的昼夜失调为特征,本研究通过对Chow和 HFD喂养的小鼠八种不同组织进行24小时代谢组学全谱分析,并绘制24小时内代谢物的时间和空间分布图,揭示了随着时间的推移在各种组织内和组织间代谢物的联系及这些联系如何被营养压力(如高脂饮食)所改变,提出在全身能量平衡和慢性营养压力(HFD)条件下如何在时间和空间上重建动态代谢关系,突出了肌肉胰岛素抵抗,肝脏脂肪变性,动脉粥样硬化和能量消耗减少之间的时间关系,以推动代谢物分析超越简单的诊断和生物标记物检测,转向预防性医学层面,更好地预测代谢物特征如何被控制以影响所需的代谢结果。
本研究还显示了BAT代谢物脂质波动的丧失以及嘌呤核苷酸的重新波动可能与UCP1功能相关(Fig. 7B)。白昼期NAD+波动的丧失可说明嘌呤核苷酸降解受损,通过在该关键时间点期间增加GMP水平来促进UCP1抑制。例如糖尿病患者红细胞中观察到GMP,IMP和AMP水平升高,血液嘌呤核苷酸升高是代谢疾病的常见病理生理结果。HFD中BAT的NAD+和NAM波动的丧失可能是由于其形成过程中涉及的酶的昼夜节律破坏引起。关键的时钟基因(Bmal1, Clock)和调节NAD+形成的BAT昼夜节律基因(Sirt3, Nampt)的表达被HFD改变,同时调节嘌呤核苷酸代谢(Impdh1和Gmpr)和产热(Ucp1)基因的昼夜节律表达受到HFD的严重影响。 因此,BAT昼夜节律功能可能涉及转录调节和代谢物之间的紧密协调。
总之,研究结果表明了不同饮食条件下代谢物随着时间在各种组织内和组织间出现代谢重建,不过,需要进一步的研究来阐述亚细胞代谢物动态变化,并监测器官间代谢物通量。该研究为以后的动物研究(何时处死,取何种组织等)以及临床研究(营养干预方案、锻炼方案、何时干预等)奠定了基础。
参考文献: Dyar K A, Lutter D, Artati A, et al. Atlas of Circadian Metabolism Reveals System-wide Coordination and Communication between Clocks[J]. Cell, 2018, 174(6):1571.





 浙公网安备33010802007965号
浙公网安备33010802007965号