高级别浆液性卵巢癌(HGSOC),起源于卵巢或输卵管,是卵巢癌患者死亡的主要原因,所占比例较大,且死亡率居高不下,主要原因是由于晚期诊断和获得性化疗的耐药性。因为卵巢和输卵管隐藏在腹腔内,所以80%罹患HGSOC的患者都是在癌细胞扩散后被诊断发现的。而目前的治疗方式多以肿瘤切除手术和卡铂/紫杉醇化疗相结合为主,虽然是一种可以达到延长五个月的积极治疗,但是80%的患者会遭遇腹内复发,以至于后续会经历连续几轮毫无治愈期望的化疗。
但是,也有六分之一的患者在初步诊断为晚期癌扩散后仍然无疾病生存超过10年。目前为止,没有已知的分子机制与这种延长的生存期相关联,并且没有良好的预测标记来区分这些患者与其他患有HGSOC的患者。因此,鉴定对化疗有利的反应和某些患者的长期生存所依据的肿瘤内在的易感特征对于疾病的预防与治疗将是非常有用的。
虽然癌症的主要研究集中在基因水平,但是蛋白质作为执行生物学功能的生物大分子,蛋白质组学技术能够对细胞系统进行非常深入,定量的分析,可以在蛋白水平上窥探疾病的发生机制。现有研究中,科学家通过大规模蛋白质组学已将蛋白质水平变化与基因水平变化相关联,突出了如何将乙酰化和磷酸化特征与同源重组缺陷和生存率降低相关联。
近日(2018年09月20日),来自马克斯普朗克生物化学研究所的科学家运用定量蛋白组学、磷酸化蛋白组学技术,针对卡铂耐药和卡铂敏感患者进行分析,探究高级别浆液性卵巢癌患者的长期生存驱动力。相关研究成果发表在国际专业学术期刊Cell上。

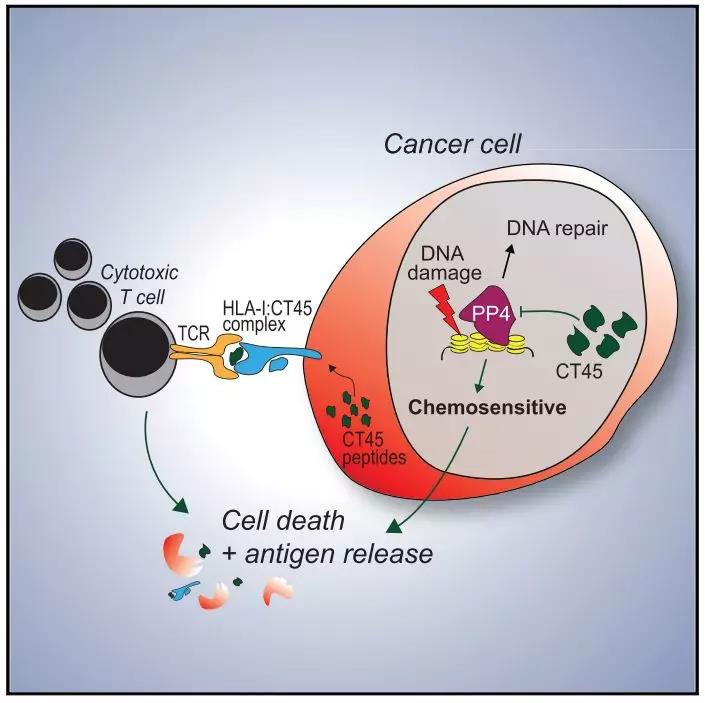
CT45作为晚期转移性HGSOC化疗后长期存活的标志物, 通过定量蛋白质组学和功能验证的结合,研究者发现CT45既可作为化学药物敏感性的细胞内在增强剂,也可以作为细胞毒性T细胞识别的非突变肿瘤抗原。预测CT45的表达将改善晚期卵巢癌患者的铂类化疗或免疫疗法的疗效。这项研究阐述了临床癌症蛋白质组学鉴定化学和免疫疗法靶点的能力,并阐明了它们的生物学作用。
1. 定量蛋白质组学分析,揭示癌症睾丸抗原CT45与疾病显著相关
研究者采集了25名未接受化疗的晚期HGSOC患者的FFPE肿瘤样本,使用Label-Free定量技术,进行蛋白质组学定量分析。
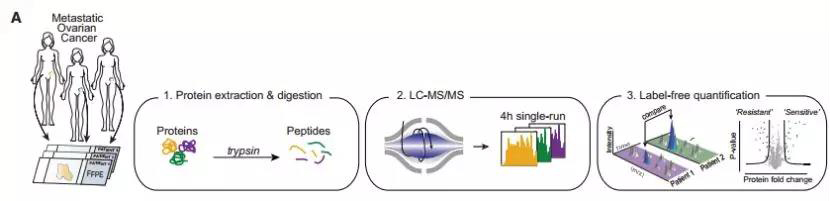
图1. 卵巢癌患者的FFPE肿瘤的蛋白质组学实验流程
研究发现患者组的总体蛋白质组变化很少(如所有肿瘤蛋白质组的主成分分析(PCA)所示,图2左)。然而,在化学药物敏感和化学药物耐药患者的比较中,发现CT45在化学药物敏感患者中表达显著(图2右)。CT45表达高的患者与无CT45表达的患者相比,无病生存期得到延长。
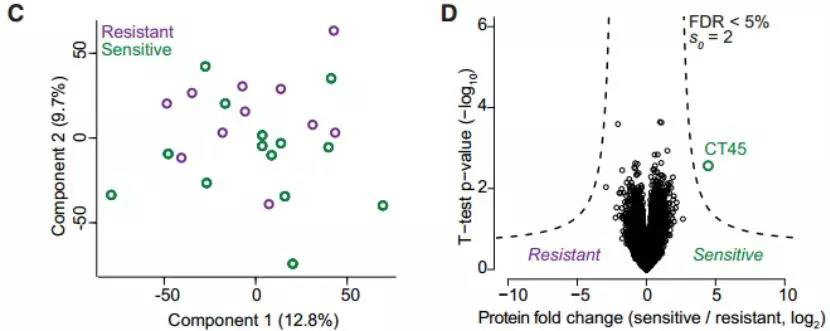
图2. 通过PCA对化疗耐药和敏感的肿瘤蛋白质组进行分组(左); 化疗耐药与敏感性肿瘤蛋白质组的火山图(右),
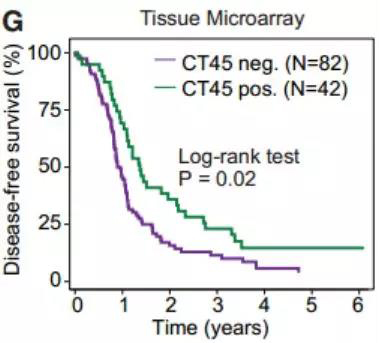
图3. 通过HGSOC TMA的CT45染色进行无病生存Kaplan-Meier分析。
比较染色评分为0(n = 82)与1+(n = 42)的晚期HGSOC患者。
2. 磷酸化蛋白质组学揭示了CT45在化学敏感性中的作用
过去研究表明,卡铂治疗诱导了DNA链间交联,其可通过Fanconi贫血(FA)信号传导途径被感知和修复。 作者为了验证FA信号传导是否被激活,在CT45和用卡铂处理的载体对照组OVCAR-5细胞上应用磷酸蛋白质组学分析。
分析显示DNA损伤信号通路被强烈激活, 其中包括FA信号通路, 与对照载体细胞相比,在用卡铂处理的CT45表达细胞中DNA损伤相关信号通路过度活化。
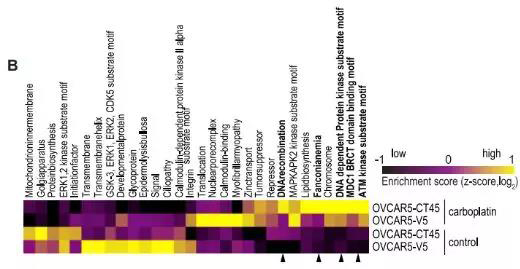
图四。 OVCAR-5细胞系对±5mM卡铂处理的磷酸化蛋白质组学分析,差异调节的途径被绘制为热图。
相对富集分数表明样品上调(黄色)和下调(黑色)途径
3. 互作蛋白组学阐明CT45在DNA损伤信号通路中的介入
为了进一步了解CT45-介导的化学药物敏感性,作者利用定量互作蛋白组学分析,发现CT45与进化保守的蛋白质磷酸酶4(PP4)复合物的相互作用 (图5).
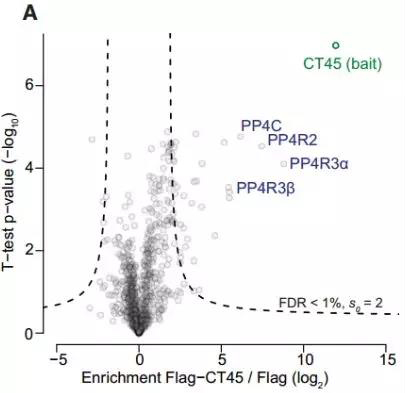
图5. 通过OVCAR-5细胞中的互作蛋白质组学筛选稳定过表达FLAG标记的CT45
此外,通过ITC测量和对在有无3mM重组GST-CT45或GST-CDC20对照蛋白的情况下免疫纯化的PP4复合物的磷酸酶活性测定,证实重组CT45在体外降低了PP4磷酸酶活性,而在等摩尔浓度下未观察到非结合对照蛋白的抑制作用。这些数据表明了CT45可充当PP4信号传导的新型内源性调节剂。
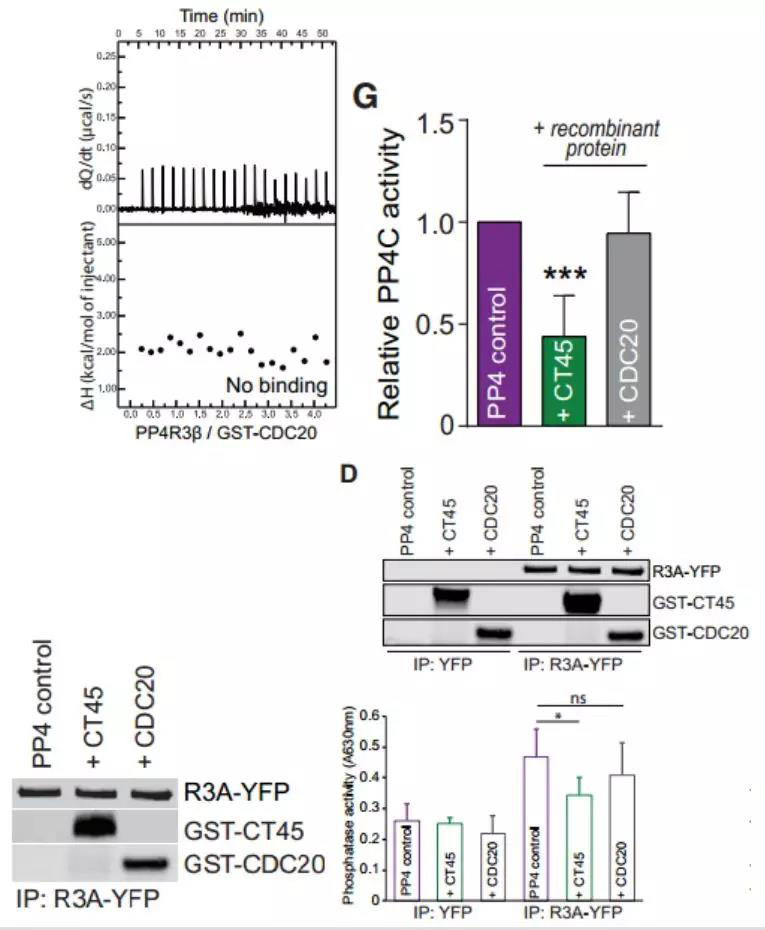
图6. ITC测量PP4R3b与GST-CDC20的结合(图上左); 在有无3mM重组GST-CT45或GST-CDC20对照蛋白的情况下免疫纯化的PP4复合物的磷酸酶活性测定, 定量结果(图上右)代表五次独立实验的平均值与蛋白印迹结果(图下左右)显示为上样对照;
接下来作者假设如果CT45降低了PP4活性,CT45表达应该在全磷酸化蛋白质组水平上可以部分模拟PP4C敲除实验。于是,作者利用磷酸化蛋白质组学分析利用siRNA; siCTRL,CT45靶向siRNA(siCT45)或PP4C靶向siRNA(siPP4C)进行转染的59M细胞.
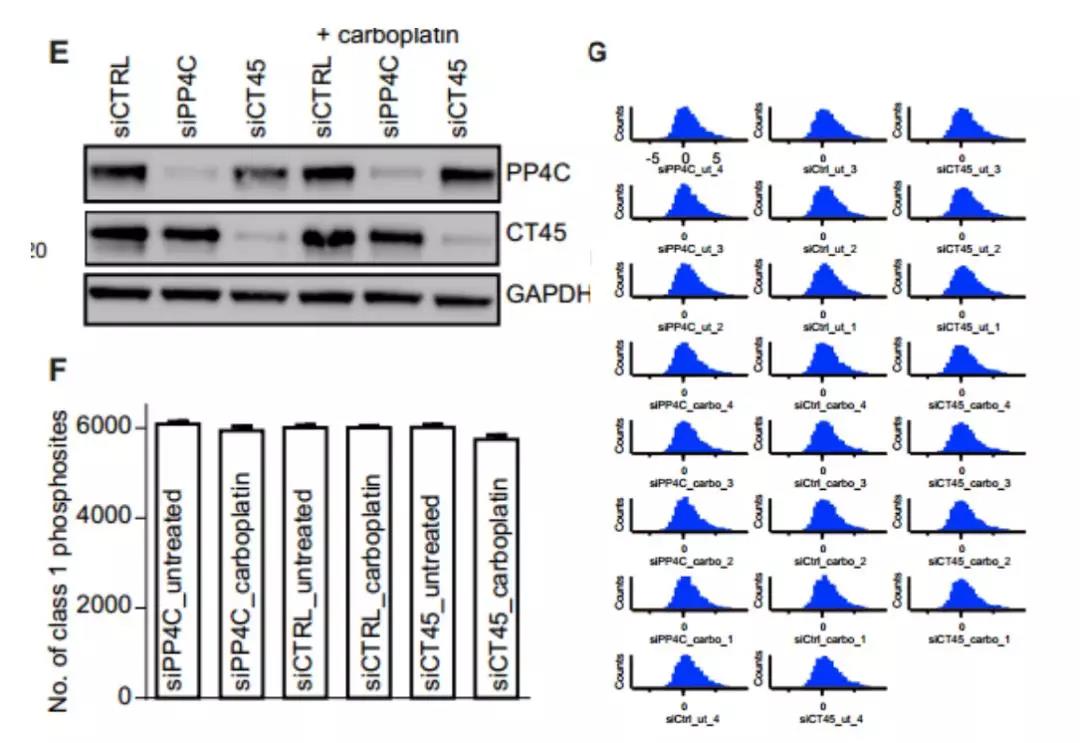
图7. 59M细胞的蛋白印迹结果用于验证磷酸化蛋白质组学分析(左上); 在每个样品组中鉴定I类磷酸化位点的数量(左下); 所有磷酸化位点的强度分布(右)
此外, 聚类分析揭示了CT45表达和PP4C敲除细胞簇功能富集与DDR信号传导相关的磷酸化位点。其中包括在S473处的KAP1的磷酸化,S473是已知的PP4调节位点,对于DNA损伤的细胞周期检查点控制是重要的(图6下左)。 CT45敲除的细胞中该磷酸化位点的强度最低,表明PP4活性高于siPP4C和siCTRL(表达CT45)细胞。 对CT45染色质互作组的分析证实,PP4及其底物KAP1均与CT45定位于相同的染色质环境,以及其他强烈富集的DNA损伤和修复蛋白(图6下右). 以上数据显示CT45直接抑制了PP4活性并揭示卵巢癌患者中CT45表达,化学药物敏感性和PP4活性之间的联系。
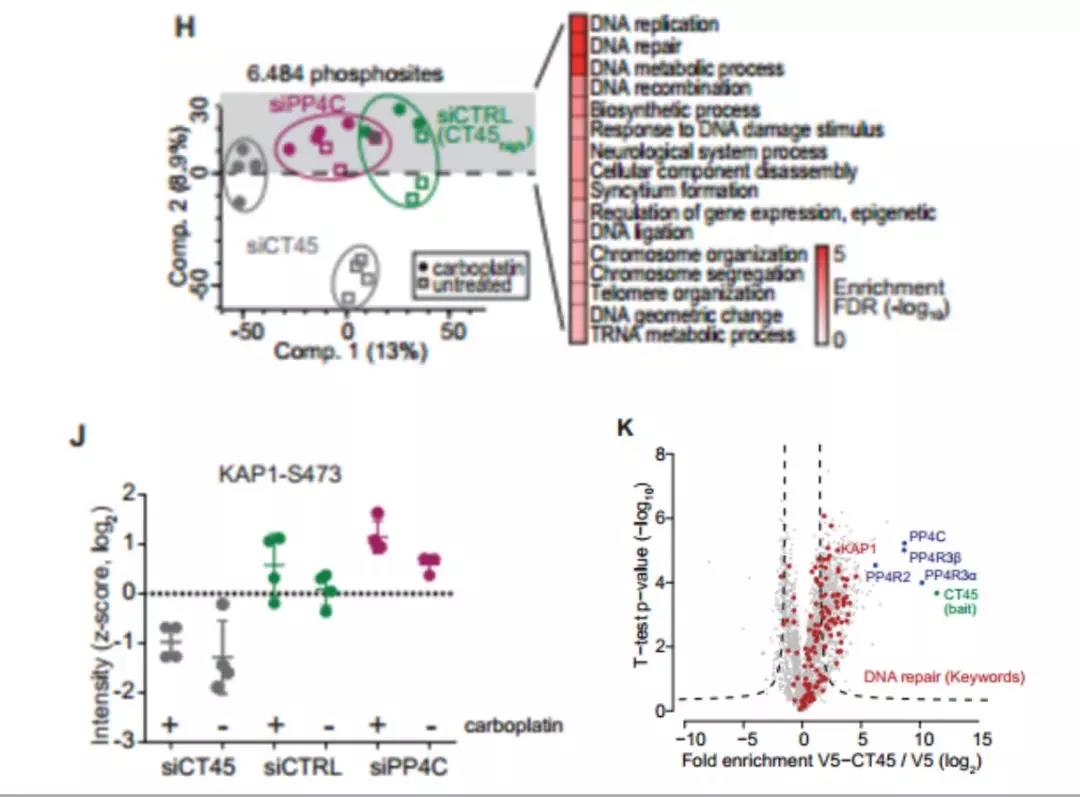 图8. 利用CT45(siCT45),PP4C(siPP4C)或对照(siCRTL)siRNA敲除59M细胞±4mM卡铂处理72小时的磷酸化蛋白质组学分析
图8. 利用CT45(siCT45),PP4C(siPP4C)或对照(siCRTL)siRNA敲除59M细胞±4mM卡铂处理72小时的磷酸化蛋白质组学分析
(上左图:基于所有磷酸化蛋白质组的主成分分析的样品组; 上右图: 沿组分2上调磷酸盐的蛋白路径富集分析);
PP4靶点的KAP1-S473磷酸化位点强度(下图左);
V5标签的OVCAR5-V5-CT45对比OVCAR5-V5细胞系中染色质 - 免疫沉淀质谱(ChIP-MS)火山图(下图右)
4. 免疫肽段组学证实CT45作为原发肿瘤抗原可以被DNA甲基化调控
由于CT45的高肿瘤特异性和免疫原性被认为是前景的免疫治疗靶点, 而后作者探究了免疫应答在CT45表达的患者长期存活中是否可能发挥作用。理想的免疫治疗靶标应在癌组织中高表达,而不在正常,健康的组织中表达。分析了37种正常组织的公共RNA-seq数据集后发现CT45仅在睾丸中表达, 证实了CT45是一个经典的癌症睾丸抗原(CTA). 之后发现经过DAC处理的SKOV3ip1卵巢癌细胞的蛋白质组学分析显示,CT45与CTAs NY-ESO-1,MAGEA4和SSX2一起位于前十大上调蛋白中 (图7)。
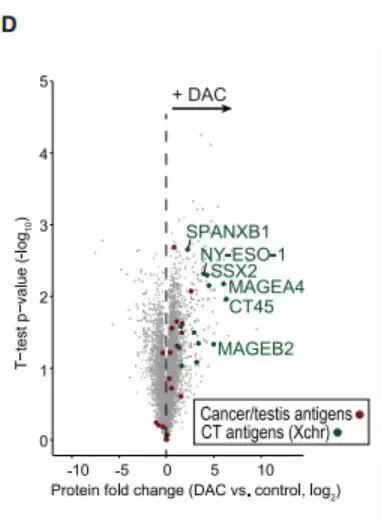
图9. DAC治疗组和对照组SKOV3ip1卵巢癌细胞之间蛋白质组学比较的火山图
5. CT45肽段激活了癌患者体内的毒性T细胞
作者通过Ki-67和细胞内干扰素g(IFNg)染色评估,发现CT45肽(而非对照肽)均诱导CD8 + T细胞活化。
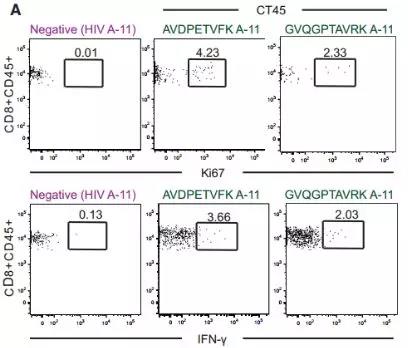
图10 . 流式细胞分析(利用两种CT45肽段(AVDPETVFK和GVQGPTAVRK)或一种HIV阴性对照肽段刺激后, 对A-11:01 CD8 + T细胞的细胞内IFN-γ和Ki-67细胞染色)
本文作者为了探究高级别浆液性卵巢癌患者的长期生存驱动力,进行了卡铂耐药和卡铂敏感患者的定量蛋白组学分析。研究发现癌症睾丸抗原CT45作为一个独立预后因素,与癌症晚期患者无病生存率增加一倍相关。
磷酸化蛋白组学与蛋白互作组学分析发现CT45与DNA损伤通路的关联性,并与PP4磷酸酶复合物可直接作用。体外实验证明了CT45调控了 PP4活性, 利用CT45的表达上调增加了DNA损伤水平与对卡铂的敏感性。
随后,研究者用免疫肽段组学实验证实了源自CT45的HLA class l肽段, 激活了患者体内毒性T细胞, 促进了对肿瘤细胞的吞噬. 这项研究阐述了临床癌症蛋白质组学鉴定化学和免疫疗法靶点的能力,并阐明了它们的生物学作用。
这项研究阐述了临床肿瘤蛋白质组学鉴定化学和免疫疗法靶点的能力,并阐明了它们的生物学作用。
参考文献:
Coscia, et al. (2018), Multi-level Proteomics Identifies CT45 as a Chemosensitivity Mediator and Immunotherapy Target in Ovarian Cancer. Cell. 175, 159–170.





 浙公网安备33010802007965号
浙公网安备33010802007965号