近几年代谢组学的研究如火如荼的开展,极大地促进了各学科的发展,如疾病诊断与治疗、营养学、环境毒理学、进化和发育及药物等;与此同时,质谱成像技术(mass spectrometry imaging, MSI)结合质谱分析和影像可视化,凭借其样本处理简单、能反应多种分子在空间上的分布及分子结构信息而受到高度的关注;尤其2004年Cooks等[1]将ESI源去掉封闭外壳,开发了常压敞开式解析电喷雾离子化(DESI)技术并成功用于质谱成像分析,更促进了MSI在临床医学、药学和植物学等领域的应用[2]。随后,空间代谢组学(Spatial Metabolomics)也应运而生,它将组学信息扩展到了二维乃至三维的水平,研究小分子在组织切片中的空间分布,告诉我们变化“在哪里发生”,从而极大拓展了人们对组学样品信息的认知[3-4]。
由于DESI等离子化技术需要被测样品与采样锥孔之间非常近,才能保证足够高的灵敏度,而对于较大的组织样品,无法将样本放进离子化探针所在位置,难以将离子有效传输到质谱分析器进行高灵敏分析。鉴于此,药物所“天然药物活性物质与功能国家重点实验室”再帕尔•阿不力孜教授课题组主导研发了新型敞开式空气动力辅助离子化(Airflow-assisted desorption electrospray ionization,AFADESI)及其质谱成像技术(AFADESI-MSI)技术,借助0.5米或更长的传输管,实现了远距离离子传输,放置样品的空间非常充裕,且可轻松调整位置(图1),并将该技术用于整体大鼠体内药物成像分析[5-6]和肿瘤生物标志物的原位筛查及免标记分子病理诊断的研究[7-8]。
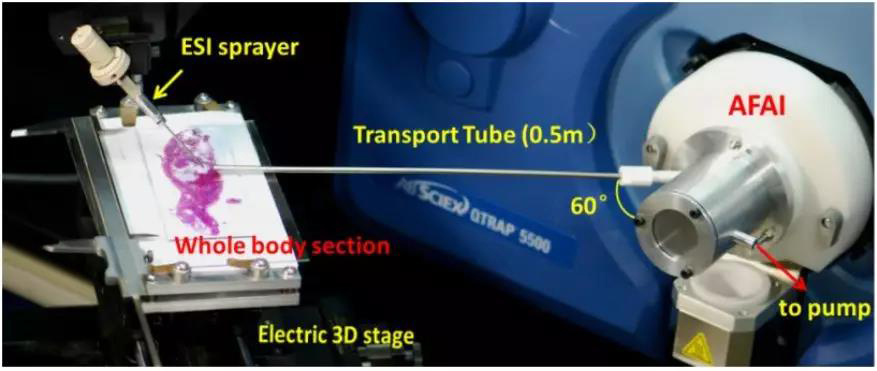
图1 AFADESI-IMS系统[5]
近期,再帕尔·阿不力孜教授又将AFADESI-MSI技术与传统免疫组织化学技术(Immunohistochemistry,IHC)进行结合,对256个患有食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)的病人的样品进行组织空间特异性的代谢组学分析,实现了对肿瘤相关的代谢物和代谢酶进行高通量分析,并将其研究成果发表在PNAS上[9]。
本期文献分享
Spatially resolved metabolomics to discover tumor-associated metabolic alterations. Proc. Natl. Acad. Sci. U.S.A. 2019 01 02;116(1)Proc. Natl. Acad. Sci. U.S.A. 2019 01 02;116(1). IF=9.580
技术路线
为实现高通量原位检测与肿瘤相关的代谢物和代谢酶,课题组首先利用AFADESI-MSI技术获取不同组织(根据细胞类型和组成分为:癌症组织、上皮组织和肌肉组织)空间特定区域的代谢物轮廓,再结合PLS-DA模型获得ESCC和正常组织间的差异代谢物,随后通过代谢通路分析选出可能与ESCC相关的酶;最后通过IHC技术用癌旁组织对与ESCC相关的酶进样验证(图2)。
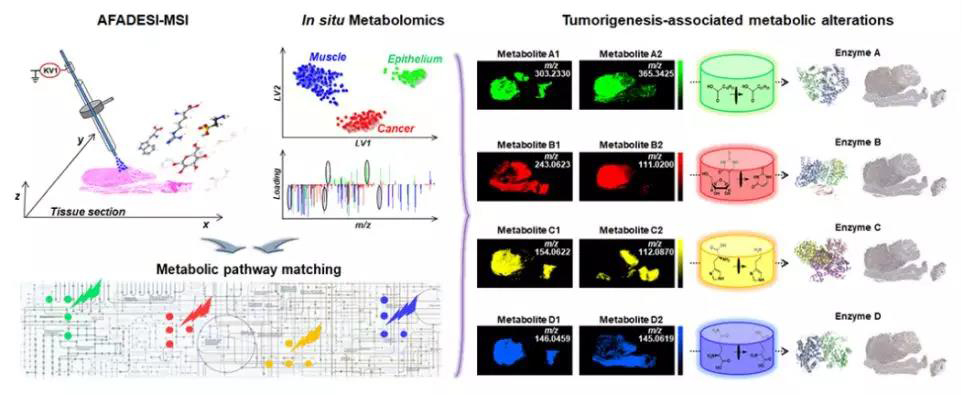
图2 技术路线
结 果
通过该技术,能明显发现甘油磷脂、葡萄糖酸、嘧啶、组氨酸、脂肪酸、精胺和脯氨酸在癌症组织和正常组织中表达量的差异(图3)。
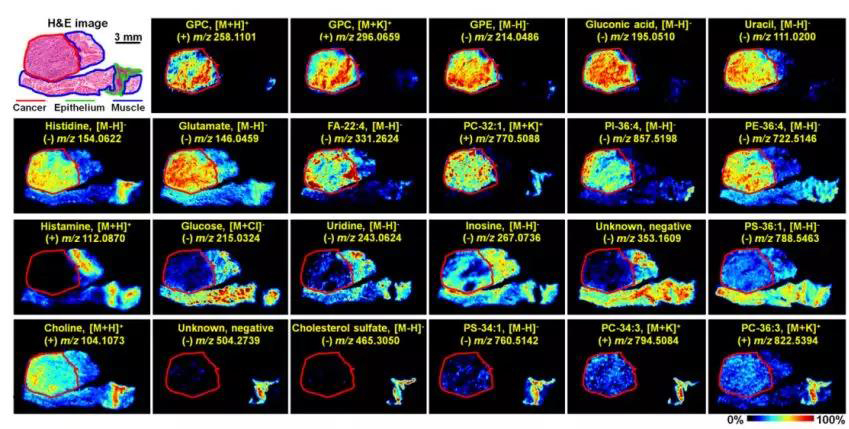
图3 ESCC组织区域特异性空间分布图
进一步的通路分析表明,脯氨酸合成、组氨酸代谢、谷氨酰胺代谢和脂肪酸合成等代谢通路在ESCC患者中发生改变,最后通过IHC验证发现吡咯啉-5-羧酸还原酶2(PYCR2)、谷氨酰胺酶(GLS)、鸟苷磷酸化酶(UPase1)、组氨酸脱羧酶(HDC)、脂肪酸合成酶(FASN)和鸟氨酸脱羧酶(ODC)在癌症组织中发生了紊乱,尤其是PYCR2和UPase1首次发现在ESCC中异常表达(图4)。
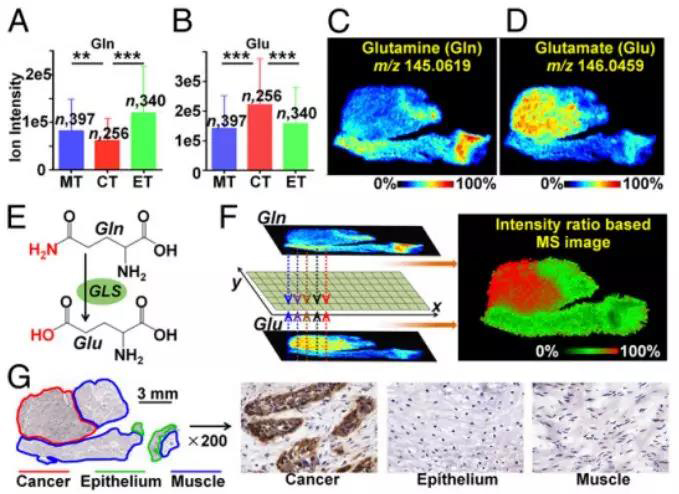
图4 谷氨酰胺代谢通路中代谢物和酶的空间分布图
最后,课题组又用36个新收集的样本进样验证,发现模型的准确率达到94.4%,且筛选的差异代谢物在不同组织样本上的分布仍有较高的特异性。
结 论
据报道[10],AFADESI-MSI的检测灵敏度达到pg级水平,含量动态范围跨越3个数量级,能检测出1500多个代谢物,同时也能精确表征与识别代谢物在组织亚区域的分布特征;而本文将其与IHC方法结合,为研究癌症的发病机制提供了代谢水平的分子依据,并为癌症的诊疗干预提供了新的潜在靶点。随着质谱成像技术、质谱成像可视化处理及定量等关键技术的不断突破,以MSI技术为基础的“空间代谢组学”也能为大家的研究提供新思路和新视角。
原文下载链接:https://pan.baidu.com/s/1IKElpWIUvfhS2PbnQNLePg
提取码:1q8i
参考文献
[1] Takáts Z, Wiseman JM, Gologan B, Cooks RG. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization. Science, 2004, 306: 471–473.
[2] Manicke NE, Dill AL, Ifa DR, Cooks RG. High-resolution tissue imaging on an orbitrap mass spectrometer by desorption electrospray ionization mass spectrometry. J Mass Spectrom, 2010, 45: 223–226.
[3] Berin Boughton, Ute Roessner. Imaging Mass Spectrometry for Spatial Metabolomics. AUSTRALIAN BIOCHEMIST , Vol 46 No 3 December 2015.
[4] Benedikt K Geier, et al. Spatial metabolomics of in situ, host-microbe interactions. https://doi.org/10.1101/555045.
[5] He J, et al. Air flow assisted ionization for remote sampling of ambient mass spectrometry and its application. Rapid Commun Mass Spectrom. 2011 Apr 15;25(7):843-50.
[6] Luo Z, et al. Air flow-assisted ionization imaging mass spectrometry method for easy whole-body molecular imaging under ambient conditions. Anal Chem. 2013 Mar 5;85(5):2977-82.
[7] Tiegang Li, et al. In situ biomarker discovery and label-free molecular histopathological diagnosis of lung cancer by ambient mass spectrometry imaging. Sci Rep. 2015 Sep 25; 5:14089.
[8] Xinxin Mao et al. Application of imaging mass spectrometry for the molecular diagnosis of human breast tumors. Sci Rep. 2016 Feb 12; 6:21043.
[9] Sun C, et al. Spatially resolved metabolomics to discover tumor-associated metabolic alterations. Proc Natl Acad Sci U S A. 2019 Jan 2;116(1):52-57.
[10] Jiuming He, et al. A Sensitive and Wide Coverage Ambient Mass Spectrometry Imaging Method for Functional Metabolites Based Molecular Histology. Adv Sci (Weinh). 2018 Nov; 5(11): 1800250.
转载于 Biotree 阿趣代谢





 浙公网安备33010802007965号
浙公网安备33010802007965号