● 期刊:Hepatology
● IF=14.971
● 发表时间:2019-08-23
实验内容
靶向胆汁酸检测、16s RNA、生理生化检测及qPCR
研究思路

非酒精性脂肪性肝病(NAFLD)影响大约20%到30%的世界人口,是导致终末期肝病、癌症的主要原因。尽管如此,被称为“瘦非酒精性脂肪肝”或“瘦患者非酒精性脂肪肝”实体的存在和临床进程一直是激烈辩论和争议的主题。“瘦非酒精性脂肪性肝病”指的是在正常体重指数(BMI)的情况下表现出疾病。越来越多的证据表明,瘦型非酒精性脂肪性肝病可能是一种独特的病理生理学实体,其中大约一半(47%-65%)患有非酒精性脂肪性肝炎(NASH)。瘦型非酒精性脂肪性肝病的自然史特征更不明显,与肥胖的非酒精性脂肪性肝病相比,其发病机理和机制令人困惑且了解不多,瘦型非酒精性脂肪性肝病的治疗方案仍未确定。
对于代谢体内平衡,除了神经内分泌轴、热量摄入和体力活动外,肠肝循环,包括胆汁酸(BAs)及其代谢物和肠道微生物群也密切相关。胆汁酸是胆固醇分解代谢的主要途径,最近的证据表明,膳食胆固醇的高摄入、肝胆固醇水平的升高和肝胆固醇稳态的破坏是非酒精性脂肪肝的关键驱动因素。有研究表明,与肥胖的非酒精性脂肪肝相比,瘦型的胆固醇摄入量更高。胆汁酸还调节葡萄糖和脂质代谢以及能量消耗,而它们的生产、运输和代谢又由特定的核胆汁酸受体FXR和FGF19调节,这可能是通过依赖和独立的机制实现的。肠道微生物群也与多种代谢疾病的发病机制密切相关,包括体重调节、非酒精性脂肪肝和肝癌,部分是通过与胆汁酸的直接作用。
本研究针对临床瘦型、肥胖型非酒精性脂肪肝患者和瘦型正常人以及动物模型的研究,证实了肠道菌群及胆汁酸在不同类型的非酒精性脂肪肝中的差异及作用。
研究结果
1.瘦型NAFLD的临床和遗传学特征
本研究共招募了538例经活检证实为NAFLD的患者,有99人(18%)是瘦人。除了低BMI,相较于非瘦型患者,瘦型患者有更低的腰臀比(WHR)和更良好的代谢状况,包括糖尿病频率、高血清高密度脂蛋白(HDL)、血清甘油三酯、空腹血糖和内稳态模型评估胰岛素抵抗(HOMA-IR)值等。组织学上,瘦患者的纤维化评分和NAFLD活性评分较低,血清丙氨酸氨基转移酶(ALT)较低。总的来说,与非瘦性NAFLD相比,瘦性NAFLD具有良好的代谢和组织学特征。
瘦型非酒精性脂肪肝患者携带TM6SF2 rs58542926 (T)等位基因的患病率明显高于非瘦型患者,但PNPLA3 GG多态性的患病率相似。在一个多变量模型中,矫正年龄、性别、谷丙转氨酶、糖尿病、总胆固醇水平、纤维化、脂肪变性和PNPLA3基因型因素,但TM6SF2 rs58542926 (T)等位基因仍然与瘦型NAFLD相关。
2. 血清胆汁酸与NAFLD的严重程度有关
胆汁酸与NAFLD纤维化分期的关系。所有胆汁酸在无/轻度纤维化和明显纤维化患者之间的分布如图1A所示。显著纤维化(≥F2)患者的总胆汁酸水平、初级胆汁酸水平和次级胆汁酸水平均高于无/轻度纤维化(F0-F1)患者(图1B)。在个体胆汁酸水平上,显著纤维化患者的胆汁酸水平明显高于无/轻度纤维化患者(图1C)。同样,显著纤维化患者的甘氨酸和牛磺酸结合态胆汁酸水平显著高于无/轻度纤维化患者(图1D,E)。胆汁酸水平和纤维化之间的关系仍然是通过多变量线性回归分析矫正年龄、BMI、性别、糖尿病、ALT和血小板等因素。

图1
3.瘦NAFLD患者血清胆汁酸水平较高
接下来,探讨瘦型和非瘦型NAFLD患者胆汁酸的差异。有趣的是,与非瘦NAFLD患者相比,瘦型NAFLD患者的总胆汁酸、初级性和次级性胆汁酸水平更高,其中次级胆汁酸呈显著差异(图2B)。瘦型NAFLD患者与非瘦型NAFLD患者个体的胆汁酸组成也存在差异,其中瘦患者的脱氧胆酸(DCA)、糖基脱氧胆酸(GCDCA)、糖基脱氧胆酸(CDCA)较低,而糖基胆酸(GCA)较非瘦患者较多(图2A)。与非瘦型NAFLD患者相比,瘦型NAFLD患者的总结合态胆汁酸和总非结合态胆汁酸均无显著性升高。
鉴于胆汁酸谱与纤维化的相关性强,还研究了纤维化分期、胆汁酸与瘦型NAFLD的关系。当以这种方式分析时,在轻度纤维化(F0-F1)患者中,与非瘦性NAFLD患者相比,瘦性NAFLD患者的总次级胆汁酸水平更高。在纤维化程度较重的患者中,瘦型和非瘦型患者无显著差异(图2C,D)。造成这种差异的主要是次级胆汁酸为DCA和UDCA(图2E,F)。
在随后的分析中,确定了与次级胆汁酸水平相关的临床因素。一致地,在单变量分析中,BMI、纤维化和肿胀与次级胆汁酸水平相关。在多变量分析中,只有BMI和纤维化阶段独立地与次级胆汁酸水平呈负相关和正相关。

图2
4.瘦型NAFLD患者血清FGF19水平较高
FXR失调与NAFLD的发病机制有关;因此,作者需要确定瘦型NAFLD和非瘦型NAFLD是否存在差异效应。为了检验这一点,测定了FXR活性的替代标记血清FGF19。在本分析中,FGF19水平随着纤维化程度的进展而降低(图3A)。瘦型NAFLD患者的FGF19水平明显高于非瘦型NAFLD患者(图3B)。有趣的是,当按纤维化严重程度分类时,轻度纤维化(F0-F1)的差异更大,随着纤维化严重程度的增加,反之亦然;然而,这并不显著(图3C)。

图3
5.瘦型NAFLD患者C4(7-alpha-hydroxy-4-cholesten-3-one)水平较低
为了研究瘦型和非瘦型NAFLD中胆汁酸代谢的差异,测定了胆汁酸合成中间体C4的含量,作为从头合成胆汁酸的标志。本分析中,根据纤维化分期,C4水平无差异(图3D)。然而,正如预期的那样,与非瘦型NAFLD患者相比,瘦型NAFLD患者的C4水平显著降低(图3E)。这种差异在轻度纤维化(F0-F1)患者中更为明显,而在中度/重度纤维化(F2-F4)患者中则不明显(图3F)。瘦型NAFLD患者有独特的微生物群分布。
肠道微生物群的组成及其与胆汁酸的相互作用影响着FXR介导的肝脏和肠道信号通路,并与NAFLD的发病机制有关。在门水平上,根据瘦与肥胖的BMI状况,肠道微生物组的分类组成没有差异。在属水平上,Erysipelotrichaceae UCG-003以及梭菌目中的几个细菌属,包括Ruminococcus, Clostridium sensu stricto 1, Romboutsia, 以及Ruminococcaceae UCG-008,这些菌群在瘦型患者中丰度较高,而Ruminiclostridium和Streptococcus在肥胖型患者中丰度较高(图4)。

图4
6.与瘦型健康人相比,瘦型NAFLD患者有不同的胆汁酸谱和微生物群分布
与瘦型健康人相比,瘦型NAFLD患者的总胆汁酸、初级胆汁酸和次级胆汁酸均显著升高。瘦型健康人与无/轻度纤维化的瘦型NAFLD患者FGF19水平无显著差异(F0-F1)。然而,在中度/重度纤维化(F2-F4)的瘦型NAFLD患者中,FGF19水平明显低于瘦型健康人。对微生物群的分析表明,瘦型健康人和瘦型NAFLD有很大差别,瘦型NAFLD患者Dorea的丰度增加,而Marvinbryantia 和 Christensellenaceae R7丰度降低。
7.小鼠瘦型NAFLD模型胆汁酸含量增加,肠道菌群发生改变
为了进一步验证假设,研究了瘦型和非瘦型NAFLD小鼠模型中胆汁酸水平和肠道微生物群的变化。小鼠被喂食高胆固醇(ChR)或高蔗糖食物16周。与之前的研究一致,喂食ChR饲料的小鼠尽管发生NAFLD,但仍然保持瘦的体型,而喂食高蔗糖饲料的小鼠体重显著增加。组织学图像如图5A所示。与我们的人类实验结果一样,喂食ChR饲料的小鼠的总胆汁酸、初级胆汁酸和次级胆汁酸均显著升高(图5B)。回肠fgf15(与人类FGF19相当)的分析显示,与高蔗糖饮食相比,喂食ChR的小鼠回肠fgf15的水平显著升高(图5C)。
对微生物群落的分析表明,组成发生了变化,这广泛反映在两个主要门——厚壁菌门和拟杆菌门,以及放线菌门、蓝细菌门和变形菌门——相对丰度的显著变化上。与高蔗糖喂养的小鼠相比,ChR喂养的小鼠的拟杆菌门相对丰度增加,厚壁菌门减少(图5D)。人类身上同样的趋势也被注意到,在喂食高胆固醇饮食(瘦型NAFLD)的小鼠中,乳球菌科的数量丰富。

图5
8.在瘦非酒精性脂肪性肝病模型中,抑制胆汁酸再吸收可改善脂肪性肝炎
最后,为了研究本结果的治疗意义,对ChR日粮喂养的小鼠(瘦型NAFLD)进行了添加或不添加胆汁酸转运抑制剂(ASBTi) (SC-435)的治疗,该抑制剂介导胆汁酸主动重吸收进入肠肝循环。补充SC-435可降低肝脏/体重比、肝脏总胆固醇和游离胆固醇积累,但不影响身体或附睾重量。组织学上,SC-435治疗降低了炎症和纤维化,降低了非酒精性脂肪肝活性评分(NAS) (图6B)和血清ALT水平(图6C)。与预期一样,炎症和纤维化标志物的信使RNA (mRNA)表达降低(图6D)。在进一步的分析中,SC-435治疗导致胆汁酸谱发生改变,FXR激动剂胆汁酸(如DCA和TDCA)升高 (图6E),回肠fgf15水平升高,参与调控胆汁酸的视黄质X受体(RXR)、FXR等在肝脏中的mRNA表达上升(图6E)。有趣的是,与对照小鼠相比,喂食SC-435增加了小鼠的盲肠重量并改变了肠道微生物群,增加了类杆菌的相对丰度,并降低了拉克氏菌科的相对丰度(图6F)。

图6
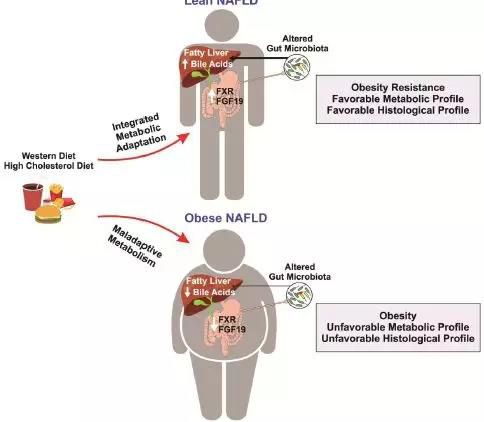
最后如下图所示,展示了瘦型和肥胖型NAFLD患者的病理生理学差异模型。瘦患者具有较好的代谢和肝脏组织学特征。瘦患者对导致体重增加的环境有适当的代谢适应,这与瘦患者对肥胖有抵抗能力的观点是一致的。补偿性机制包括胆汁酸和FXR活性的增加,以及独特的肠道微生物群分布,这些解释了脂肪变性发展过程中有利的分布。在瘦型和肥胖型NAFLD小鼠模型中也观察到类似的特征。
转载于小迈 迈维代谢





 浙公网安备33010802007965号
浙公网安备33010802007965号