Science:新的细胞生长补偿途径可以帮助更好地治疗转移性癌症
DOI: 10.1016/j.isci.2019.06.029
虽然研究人员对原发癌细胞的生长有一个基本的了解,但对癌症扩散的致命过程转移却知之甚少。加州大学洛杉矶分校(UCLA)牙科学院院长、牙周病教授Paul Krebsbach博士领导的一个研究小组发现,去年发现的mEAK-7基因可能在癌症转移中发挥重要作用,至少在肺癌中是如此。这项研究发表在《iScience》杂志上。在早期人类细胞基因发现的基础上,研究小组利用几个数据库的肿瘤细胞遗传信息以及癌症患者的组织样本,比较了正常细胞和癌细胞中mEAK-7的表达水平。
图片来源:NIH
通过对非小细胞肺癌的研究,研究人员发现mEAK-7在转移性非小细胞肺癌中高表达,而mEAK-7对细胞增殖和迁移非常重要。研究人员还发现,当mEAK-7与一种名为DNA-PKcs的大分子结合时(DNA-PKcs有助于调节DNA修复和控制或增强癌症生长),就创造了另一种mTOR信号通路,用于癌细胞的生长和增殖。在正常细胞中,有两种被广泛研究的途径是由一种叫做mTOR的基因控制的,这种基因调控正常细胞的生长、增殖和存活。研究人员还研究了癌症干细胞中的这些信号分子,他们发现,癌细胞中的"第三"mTOR复合物由mTOR、mEAK-7和DNA-PKcs组成。
Nat Commun:科学家发现促进卵巢癌转移的罪魁祸首-"Ran蛋白"
DOI:10.1038/s41467-019-10570-w
你知道吗?90%的癌症患者都死于癌细胞的远端转移,癌症的远端转移,即癌细胞拥有在机体中移动的能力,并能入侵到患者机体的其它健康组织中,近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自蒙特利尔大学的科学家们通过研究阐明了名为Ran的蛋白质在卵巢癌细胞移动过程中所扮演的关键角色,如果没有Ran蛋白的帮助,癌细胞或许无法从癌变位点进行扩散。
Ran是一种穿梭蛋白,其主要会支持细胞内部和细胞核之间物质的运输,如今研究者发现该蛋白也参与了癌症的发生和癌细胞的生存;在卵巢癌细胞中,研究人员发现,Ran担保或许是RhoA蛋白进入细胞膜的"出租车",而RhoA在细胞迁移过程中非常重要。研究者Mes-Masson教授说道,在正常细胞中,RhoA能够直接进入细胞膜,但在卵巢癌细胞中却并不行,但其必须在Ran蛋白的帮助下才能够到达细胞膜,而这或许需要一段旅程。研究者表示,在抑制Ran活性的癌细胞中,RhoA能够被分解,如果没有RhoA的话,癌细胞或许就会失去运动、迁移并且入侵健康组织的能力。
图片来源:Euridice Carmona, CRCHUM
如今研究人员能够解释为何Ran对于癌细胞那么重要了,在很多癌症中,Ran蛋白的高表达通常与患者预后较差直接相关;研究者Provencher表示,此前我们通过研究发现,Ran是一个很好的治疗靶点,而本文研究结果或能帮助我们理解何时以及哪些癌症患者能因这种疗法而获益,健康细胞不需要Ran就能够移动,因此研究者在靶向作用癌细胞时并不会影响健康细胞,基于本文研究结果,抑制Ran或许就有望治疗其它类型的癌症。
如今,研究人员已经开发出了能够抑制Ran的小型分子,目前他们正在临床前模型中进行试验,研究者表示,这些小分子能够有效减缓或消除癌症发生,他们希望未来有一天能够开发出新型药物在临床中治疗卵巢癌患者。在近乎三十年的时间里,研究者Provencher及其同事利用来自卵巢癌患者的样本开发出了最大的卵巢癌生物样本库,其能够帮助分析来自肿瘤组织的细胞系的特性,这些细胞系能帮助全球卵巢癌研究人员从事相关研究。
背靠背两篇Cell揭示肺癌转移新机制
DOI: 10.1016/j.cell.2019.06.005
DOI: 10.1016/j.cell.2019.06.003
瑞典和美国的研究人员在两项独立研究中报告说,肺癌细胞通过激活一种名为BACH1的蛋白质增加糖的摄取和使用,利用内源性或饮食中的抗氧化剂在体内扩散。这些发表在著名科学杂志《Cell》上的研究为新的肺癌治疗策略铺平了道路。
当癌细胞减少氧化应激时,这个过程就开始了。氧化应激可以通过两种方式之一发生:癌细胞可以从饮食中获得抗氧化剂,如维生素A、C或E,或者合成它们自己的抗氧化剂。在大约三分之一的肺癌病例中,肿瘤细胞具有与NRF2和KEAP1基因相关的特殊突变,这些突变使它们能够开始产生自己的抗氧化剂。当氧化应激消退时,新发现的基本过程就发生了: BACH1蛋白稳定下来,并在癌细胞中积累。这种蛋白质在癌细胞中按下几个启动按钮,从而刺激癌细胞的转移机制,包括一个命令癌细胞将葡萄糖代谢为细胞燃料和乳酸,并从血液中储存葡萄糖的机制。葡萄糖的使用速率越高,癌细胞扩散的能力就越强。
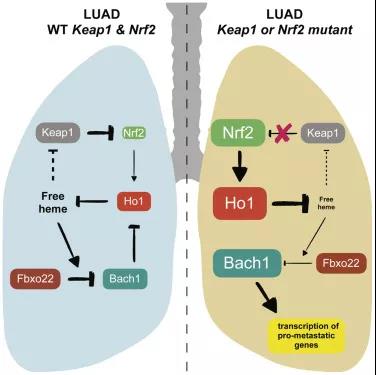
图片来源:Cell
Bergo教授和他的瑞典同事先前已经证明,抗氧化剂,如膳食补充剂中的维生素E,可以加速肿瘤的生长。当2014年首次有研究表明这一点时,他们引起了媒体的广泛关注,并引发了激烈的争论,因为人们普遍认为抗氧化剂补充剂对治疗癌症有好处。研究人员现在所做的是解释抗氧化剂是如何加速疾病的进程的。"这是我们取得的最令人兴奋的发现之一,"哥德堡大学(University of Gothenburg)临床科学系助理教授、共同通讯作者Volkan Sayin表示。"我们的研究结果也为所谓的Warburg效应如何被激活提供了一个新的解释。Warburg效应描述了癌细胞在正常有氧条件下如何吸收糖并将其转化为能量和乳酸。由于这是癌症最著名的特征之一,我们的研究结果为肿瘤学之谜提供了一个至关重要的新发现。"瑞典的研究是在卡罗林斯卡学院和哥德堡大学进行的,而美国的研究是在纽约大学进行的。这项研究和预览评论发表在《Cell》杂志上。
Nat Commun:科学家在分子水平上揭示癌症转移的新型分子机制
DOI:10.1038/s41467-019-10729-5
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自耶鲁大学的科学家们通过研究在分子水平上揭示了机体癌症转移的分子机制,同时研究者开发出了一种新型工具来检测特定癌症患者机体中引发疾病的诱导子,相关研究结果有望帮助科学家们开发治疗癌症的新型疗法。
本文中,研究者则发现,上皮间质转化过程是由细胞外基质结构的简单改变所引发的,细胞外基质扮演着细胞支架的功能,细胞基质纤维的排列或会诱发上皮间质转化过程。
研究者Andre Levchenko博士说道,在某些癌症中,在细胞离开肿瘤开始发生扩散之前,环境中就存在这种改变,当基质中的纤维开始排列时,其就会创造细胞运动的轨迹,我们在文章中揭示了这种复杂分子网络被控制的分子机制。文章中,研究者设计了一种能够模拟细胞环境的方法,同时他们在分子水平上深入分析了上皮间质转化过程,发现了两种单独的反馈机制,也就是说,两个或两个以上的分子相互抑制或激活作用,其中一种是将YAP蛋白与基因调节子WT1相联系,其会诱发细胞彼此分离,而另外一种则将YAP蛋白与TRIO蛋白相联系,其会诱发细胞开始运动,甚至增加细胞的运动速度。
当将实验分析和临床数据相结合后,研究者在肾癌患者中证实了这种机制处于活性状态;Levchenko说道,相关信息或能用来开发新型预测性技术以及新型的癌症个体化临床干预手段。本文研究结果有望帮助研究者利用特殊药物来靶向作用关键分子进而治疗癌症,后期研究人员将会继续深入研究癌症转移的分子机制,为治疗更多癌症开发新型疗法。
Nature:我国科学家揭示尿苷二磷酸葡萄糖抑制肺癌转移
DOI:10.1038/s41586-019-1340-y.
-尿苷二磷酸葡萄糖(UDP-glucose, UDP-葡萄糖)是糖醛酸途径(uronic acid pathway)中的一种代谢中间物。在一项新的研究中,来自中国科学院生物化学与细胞生物学研究所、中国科学院大连化学物理研究所、中国科学院上海药物研究所、温州医科大学附属第一医院、复旦大学和广州大学的研究人员报道了UDP-葡萄糖的一种新功能:它通过加快SNAI1 mRNA降解来抑制肺癌转移。
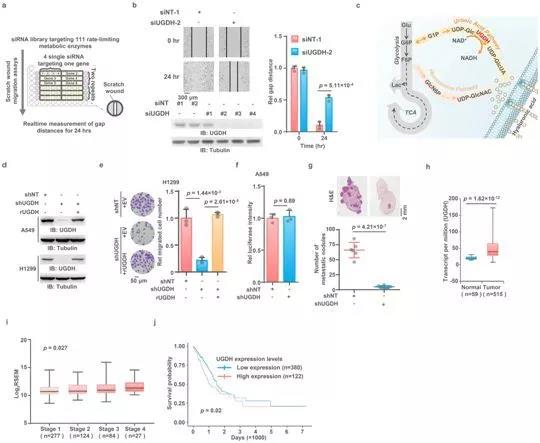
图片来源:Nature
代谢失调是癌症的标志。癌基因和肿瘤抑制基因发生的突变导致影响肿瘤细胞代谢的多种细胞内信号通路发生变化。这种独特的生化微环境进一步影响肿瘤细胞的代谢表型,从而影响肿瘤进展、对治疗的反应和患者治疗结果。这项新的研究揭示了UDP-葡萄糖在抑制肿瘤转移中的独特功能,提出了代谢物调节的蛋白功能的新模型,并建立了代谢与RNA稳定性之间的新关联性。
具体而言,这些研究人员证实在表皮生长因子受体(EGFR)受到激活后,尿苷二磷酸葡萄糖脱氢酶(UGDH)在473位点的酪氨酸(Y)上发生磷酸化。UGDH是糖醛酸途径中的限速酶。它催化UDP-葡萄糖产生UDP-葡萄糖醛酸并参与糖胺聚糖的生物合成。磷酸化的UGDH与HuR结合并将UDP-葡萄糖转化为UDP-葡糖醛酸,这会减弱UDP-葡萄糖介导的对HuR与SNAI1 mRNA结合的抑制,从而增强SNAI1 mRNA稳定性。增加的Snail(由SNAI1编码)表达接着启动肿瘤细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT),因而促进肿瘤细胞迁移和肺癌转移。此外,这些研究人员发现,较低的UDP-葡萄糖水平与肺癌的转移和复发密切相关。他们观察到转移性肿瘤中的UDP-葡萄糖水平远低于原发性肿瘤。远处转移患者的UDP-葡萄糖水平远低于无远处转移的患者,而且肿瘤组织中UGDH Y473磷酸化水平高的患者转移率较高,预后较差。
Nat Genet:震惊!大多数转移性结直肠癌在可以确诊前就已经发生转移!
DOI: 10.1038/s41588-019-0423-x
斯坦福大学医学院(Stanford University School of Medicine)的研究人员对近3000名患者进行了一项研究,研究结果于近日在《Nature Genetics》杂志上,该研究显示,多达80%的移性结直肠癌在原始肿瘤超过罂粟籽大小之前可能已经扩散到身体的远端。"这一发现相当令人惊讶,"斯坦福大学医学和遗传学助理教授Christina Curtis博士说。"在本研究分析的大多数转移性结直肠癌患者中,癌细胞已经扩散并开始生长,远早于原发性肿瘤的临床检测。这表明转移能力是在癌症诞生后很早就获得的。这违背了普遍的假设,即转移发生在晚期原发性肿瘤中,并对患者分层、治疗靶向和早期发现有影响。研究人员和临床医生认为,癌症通过逐渐积累分子变化获得转移的能力。这种想法认为,这些变化赋予了特定的特征,最终使癌细胞能够逃离周围的组织,进入血液,并在新的地方定居。在这种情况下,如果发生转移的话,将是原发性癌症进化的一个相对较晚的事件。
通过对肿瘤活检的研究,研究人员将23例原发性肿瘤的基因突变模式与肝或脑转移模式进行比较。他们寻找从同一个人身上获得的原发性和转移性癌症的异同。然后,他们利用这些模式创造出一种每个病人癌症的进化树--类似于生物学家用来追踪一个动物物种从一个祖先进化而来的进化树。研究人员拼接在一起形成的进化树表明21例患者中有17名患者的转移灶开始只有一个细胞或一小群遗传学相似的细胞,这些细胞来自于肿瘤发展的早期。
为了进一步确定转移发生的时间,Curtis和她的团队开发了一个计算机程序和统计方法来测量转移性传播的时间相对于单个患者的原发肿瘤的大小。他们的分析为人类结肠癌早期转移性传播提供了第一个定量证据--几乎在他们检查的所有病例中都观察到了这种模式。然而,Curtis指出并不是所有的结直肠癌都会转移,理解阻止癌细胞扩散到其他器官的细胞过程也很重要。
Cancer Res:乳腺癌为什么转移?可能是肠道微生物在作怪!
DOI: 10.1158/0008-5472.CAN-18-3464
弗吉尼亚大学癌症中心的一项新研究表明,不健康的、发炎的肠道会使乳腺癌变得更具侵袭性,并更快地扩散到身体的其他部位。弗吉尼亚大学微生物、免疫学和癌症生物学部门的Melanie Rutkowski博士发现,破坏小鼠体内的微生物群会导致激素受体阳性的乳腺癌变得更具侵略性。改变微生物群,即生活在肠道和其他地方的微生物群,对人体产生了巨大的影响,促使了癌症扩散。
图片来源:Levchenko lab
Rutkowski使用强力抗生素破坏小鼠的天然肠道细菌,但她强调,抗生素并不危险,乳腺癌患者或任何需要抗生素治疗感染的人都不应避免使用抗生素。毕竟,老鼠不是人,需要做更多的研究来确定长期使用抗生素与癌症结果之间是否存在关联。在这项研究中,抗生素只是达到目的的一种手段,一种为微生物群创造长期失衡的简单方法,类似于个人可能经历的长期不健康微生物群。这种效果远比一个人正常使用抗生素,甚至多次使用抗生素的效果要严重得多。
在一定程度上得益于Rutkowski的研究,医生们最终可能能够操纵微生物群,使乳腺癌患者受益。但Rutkowski说,目前的关键信息是健康微生物群的重要性。越来越多的证据表明,健康的微生物群对身体健康的许多方面都至关重要。
Rutkowski是一名癌症研究人员,而不是医生。她指出,促进健康微生物群的一些做法是人们普遍接受的。她说:"健康的饮食、高纤维、锻炼、睡眠--所有这些都有助于身体健康。如果你做了所有这些,理论上,你应该有一个健康的微生物群。我们认为,这与乳腺癌的长期有利结果密切相关。"相关研究成果发表在《Cancer Research》杂志上。
PLOS ONE:揭示前列腺癌发生骨转移的机制及过程
DOI:https://doi.org/10.1371/journal.pone.0216934
前列腺癌在扩散到骨骼后往往会变得致命,而这种致命特征背后的过程,可能会作为骨靶向放射治疗的目标,以及潜在的新疗法,转而对抗前列腺癌。杜克癌症研究所(Duke Cancer Institute)的研究人员在近日发表于《PLOS ONE》杂志上的一项研究中,描述了前列腺癌细胞如何发展出模仿成骨细胞的能力,使其能够在骨微环境中增殖。
用放射性同位素镭233攻击这些细胞,这种放射性同位素选择性地攻击骨转移中的细胞,已经被证明可以延长患者的生命。但是,我们需要更好地了解镭在骨头里是如何工作的。这种模拟过程的成像可能导致更有效地使用镭233,并开发新的治疗方法来治疗或防止前列腺癌向骨扩散。
Armstrong和他的同事们招募了一个由20名有症状的骨转移性前列腺癌患者组成的小研究小组。当分析来自研究参与者的循环肿瘤细胞时,他们发现骨形成酶似乎普遍表达,并且在这些前列腺癌细胞中骨形成通路的基因改变也很常见。他们在另一项涉及40多名前列腺癌和骨转移患者的多中心试验中证实了这些新的基因发现。在使用镭-223治疗后,研究人员发现放射性同位素集中在骨转移灶中,但肿瘤细胞仍在循环,癌症在治疗后6个月内进展。研究人员在这些肿瘤细胞中发现了一系列复杂的基因变化,这些变化可能使它们能够持续存在,并随着时间的推移产生对辐射的抵抗力。
eLife:前列腺癌标志物PSA会激活血管和淋巴管生成因子,促进癌症转移
DOI:10.7554/eLife.44478
一项新的研究表明,前列腺特异性抗原(PSA)是一种前列腺癌标志物,是激活血管内皮细胞和淋巴管生成生长因子的催化剂之一,而这些因子有助于癌症的扩散。赫尔辛基大学(University of Helsinki)的Docent Michael Jeltsch领导的研究小组与合作伙伴一起,发现了激活血管内皮和淋巴管生成生长因子VEGF-C和VEGF-D的新机制。这些生长因子不仅在胎儿发育中起着重要作用,而且在癌症的传播和转移灶的形成中也起着重要作用。
图片来源:http://cn.bing.com
大多数由癌症引起的死亡,包括前列腺癌,都是转移导致。了解导致转移的一系列事件以及相关的关键因素对于找到抑制或阻止这一进程的方法是必要的。研究人员发现了两种新的蛋白水解酶(蛋白酶),可以同时激活生长因子VEGF-C和VEGF-D。其中一种酶是前列腺特异性抗原(PSA),也被用作前列腺癌的标志物。除了前列腺,VEGF-C和PSA也存在于精液中,因此它们可能对生殖产生影响,尤其是对生育能力有影响。研究人员还发现,组织蛋白酶D能够激活VEGF-C和VEGF-D。研究人员以前已经知道组织蛋白酶D与转移的形成有关,但对其作用机制缺乏详细的了解。
Nature:重磅!科学家成功解析出转移性乳腺癌的基因组特性!
DOI:10.1038/s41586-019-1056-z
近日,一项刊登在国际杂志Nature上的研究报告中,来自巴塞尔大学等机构的科学家们通过研究成功描述了转移性乳腺癌的基因组特征,相关研究结果或为阐明乳腺癌转移的分子机制及开发新型转移性乳腺癌疗法提供新的思路和研究基础。
研究人员通过研究分析了617份转移性乳腺癌样本中的体细胞改变图谱,研究者指出,当与来自癌症基因组图谱中的早期乳腺癌样本进行对比后,他们发现,9个驱动基因在表达激素受体但HER2水平并不高的转移性乳腺癌中会频繁发生突变,这些驱动基因包括TP53, ESR1, GATA3, KMT2C, NCOR1, AKT1, NF1, RIC8A和RB1。
此外,研究人员还在HR+/HER2-转移性乳腺癌中观察到了18个扩增子活动较为频繁,这些癌症中S2、S3、S10、S13和S17的突变特性发生了明显增加,在富含基因突变的HR+/HER2-的转移性乳腺癌中,TP53、RB1和NF1突变以及S10、S13和S17与患者预后不良直接相关。相比早期阴性乳腺癌而言,转移性阴性乳腺癌表现出了与DNA修复同源重组相关的基因出现体细胞双功能突变频率增加的状况(7% vs 2%)。
研究者表示,相比早期乳腺癌而言,转移性乳腺癌表现出了突变负担和克隆多样性的增加,因此转移性乳腺癌的基因组图谱往往富含临床相关的基因组改变,而且相比早期乳腺癌也更为复杂一些,鉴别出与较差预后相关的基因组改变或能帮助研究人员对乳腺癌患者进行筛选从而在临床中更加有针对性地进行治疗。
转载于生物谷





 浙公网安备33010802007965号
浙公网安备33010802007965号