癌症复发是癌症治疗失败的主要原因,也是导致癌症病人死亡的重要原因之一。但是癌症为什么会复发呢?这是一个复杂的生物学问题,迄今为止科学家们也没有完全了解这个过程。小编在此为大家总结了关于癌症复发的最新研究,包括癌症复发的原因,以及如何治疗癌症复发。
癌症复发的根源是什么?如何治疗?
文/Sun
图片来源:http://cn.bing.com
癌症复发的根源是什么?
Cancer Cell:白血病复发的根源并不在于白血病干细胞而在于白血病再生细胞
DOI:10.1016/j.ccell.2018.08.007.
长期以来,癌症研究人员一直认为急性髓性白血病(AML)的复发是由于一群处于休眠状态并且可能免受靶向分裂细胞的化疗影响的白血病干细胞(LSC)。然而,在一项新的研究中,加拿大麦克马斯特大学的Mickie Bhatia及其同事们分析了患者样本中的癌细胞群体以及从移植到小鼠体内的AML白血病细胞中获得的癌细胞群体,结果发现白血病干细胞在化疗期间消失殆尽。相关研究结果近期发表在Cancer Cell期刊上,论文标题为“Identification of Chemotherapy-Induced Leukemic-Regenerating Cells Reveals a Transient Vulnerability of Human AML Recurrence”。
图片来源:Cancer Cell
Bhatia团队在化疗后的多个时间点对患者的骨髓细胞进行采样,与此同时对利用患者的肿瘤培养出的异种移植物也进行采样。在这两类样本中,他们鉴定了一小部分称为白血病再生细胞(leukemic regenerating cell, LRC)的细胞在基因表达谱上与白血病干细胞存在着显著的不同。Bhatia说,“这些白血病再生细胞实际上是化疗反应的产物。”白血病再生细胞仅短暂存在,而且它们的数量随着白血病复发而下降。这些白血病再生细胞的一个显著特征是表达几种G蛋白偶联受体(GPCR)。他们发现抑制白血病再生细胞中特定GPCR基因的表达可阻止接受化疗治疗的小鼠出现癌症复发。
脂肪或是胶质母细胞瘤复发及产生侵袭性的元凶
Fat fuels aggressive brain cancers
近日,来自卡迪夫大学和佛罗里达大学的科学家们通过研究发现,脂肪或许是脑癌肿瘤生长的动力。当研究人员对胶质母细胞瘤中不同类型的细胞进行分析后,他们深入研究阐明了推动癌细胞分裂的机制,这或为后期开发有效靶向作用恶性脑癌的新型疗法提供了新的线索和希望。
研究者Florian Siebzehnrubl说道,胶质母细胞瘤是成年人中最常见的一种恶性脑瘤,目前并没有有效的治疗手段。为何胶质母细胞瘤如此致命?部分原因是相同肿瘤组织中存在许多不同类型的癌细胞。因此研究人员就想通过研究来理解是什么在为不同的癌细胞供能,同时研究者也希望能利用相关研究结果开发出改善癌症患者生存率的靶向性疗法。
研究者发现,缓慢分裂的癌细胞更具侵袭性,且会对癌症疗法产生一定的耐受性,在相同肿瘤组织中,缓慢分裂的细胞所使用的“燃料”与快速分裂的细胞并不相同。研究者Siebzehnrubl补充道,快速分裂的癌细胞常常会利用糖分作为燃料,而缓慢分裂的细胞则会使用脂肪来产生能量,这一点似乎非常重要,因为缓慢分裂的细胞常常存在于复发性肿瘤组织中,这就意味着,这类细胞是肿瘤死灰复燃的罪魁祸首。
Nat Med:科学家阐明白血病复发的罕见分子机制
DOI: 10.1038/s41591-018-0201-9
单一的白血病细胞通常会不断复制并且诱发B细胞急性淋巴细胞白血病(ALL)患者出现致死性复发,而这种单一的白血病细胞常常会被工程化设计为靶向作用白血病的嵌合抗原受体(CAR)慢病毒,并被注入患者体内。近日,一项刊登在国际著名杂志Nature Medicine上的研究报告中,来自美国宾州佩雷尔曼医学院(Perelman School of Medicine)的科学家们通过研究发现,在一名患者中,通常会进入到患者机体T细胞中促进其搜寻癌症的CAR慢病毒或许会终止与白血病细胞的结合,白血病细胞中CAR的存在或许能够给予细胞通过掩饰CD19分子来躲避治疗的目的,而CD19是CARs靶向杀灭癌细胞的一种特殊蛋白,没有CD19的白血病细胞通常会对CAR-T疗法产生耐受性,因此单一的白血病细胞常常会导致患者疾病复发。
这项研究中,研究人员所开发的疗法能够修饰患者自身的免疫T细胞,而这些T细胞能被收集并且重编程使其寻找并且破坏患者的癌细胞,一旦其被输送到患者机体中后,这些细胞就会不断繁殖并且开始攻击靶向作用表达CD19分子的细胞。
医学博士Marco Ruella说道,我们发现,100%复发的白血病细胞都携带有CAR,而其能被用来对T细胞进行遗传修饰。研究人员对数百名患者进行研究观察到了患者机体白血病的发病机制,同时也提供了重要的研究证据,即任何微小的变化都可能会对患者预后产生明显的影响。研究者指出,一名20岁的患者在2016年的临床试验中接受了CAR-T疗法,在其进入临床试验时,其晚期白血病已经复发了三次,当这名患者接受被修饰后的T细胞时,在其疾病复发之前其疾病完全缓解时间达到了9个月之久。在大约60%的ALL复发患者中,其机体的癌细胞并不会表达CD19,而且在复发患者机体中也并未检测到CD19的存在,但本文研究中,研究人员通过研究却发现,白血病细胞仍然呈现出CAR蛋白的阳性结果。
Nat Commun:乳腺癌复发的新机制
DOI: 10.1038/s41467-018-05914-x
根据贝勒医学院圣路易斯华盛顿大学医学院和不列颠哥伦比亚大学的研究人员的研究,大型基因组分析将某些DNA突变与雌激素受体阳性乳腺癌复发的高风险联系起来,而其他突变与更好的结果相关联。这些知识可以帮助预测哪些患者最有可能患上癌症,并且可以帮助指导治疗决策。它还为新发现的高危突变患者开辟了更积极的治疗方法。
研究人员分析了超过2,500名雌激素受体阳性乳腺癌患者的肿瘤样本,这是该疾病最常见的形式之一。这些癌细胞具有与细胞核中的激素雌激素结合并驱动肿瘤生长的受体。这项新研究证实了过去的研究表明,MAP3K1和TP53基因中相对常见的突变对肿瘤侵袭性有相反的影响。 MAP3K1突变的患者表现良好,而TP53突变的患者可能复发。该研究还确定了三种基因--DDR1,PIK3R1和NF1--具有相对不常见的突变,这些突变与癌症复发和扩散有关。
“尽管DDR1和NF1的突变被认为是罕见的,但它们与早期复发有关,这使得它们在不幸死于该疾病的患者中更为常见,因此可能成为关键的治疗靶点,”Matthew J. Ellis,MB说。 ,贝勒医学院的BChir博士。 “他们的鉴定也为我们提供了非常重要的分子线索,探讨了侵袭性肿瘤行为的本质。”“很可能这些基因现在将被纳入基因组测试,特别是在开发针对这些突变的临床试验时需要如此”Ellis补充道。
Nat Commun:自噬或是休眠乳腺癌细胞复发的罪魁祸首之一
DOI:https://doi.org/10.1038/s41467-018-04070-6
肿瘤在初次诊断和治疗后复发是导致乳腺癌病人死亡的主要原因,因为休眠的肿瘤细胞会转移性爆发。肿瘤微环境的改变可以促使激活休眠细胞的信号通路从而导致它们增殖。但是研究人员并不知道涉及转移的休眠乳腺癌细胞短期及长期存活的过程。
近日,来自美国国立卫生院和德克萨斯大学MD安德森癌症中心的科学家在癌症研究所癌症生物学和遗传学部Kent W. Hunter和Jeffrey E. Green教授的带领下发现自噬是转移性休眠乳腺癌细胞生存的一种关键机制。使用药物或者遗传学手段抑制休眠乳腺癌细胞的自噬可以显著抑制小鼠以及人类乳腺癌临床前休眠3D模型中癌细胞的存活时间以及转移灶的形成。
通过体内实验,研究人员发现自噬基因自噬相关基因7(ATG7)是涉及自噬激活的关键基因。从机制上讲,抑制休眠乳腺癌细胞中的自噬通路导致损伤线粒体及活性氧的富集,从而导致了癌细胞凋亡。因此,抑制自噬是一种清除休眠癌细胞并防止乳腺癌复发的潜在机制之一。
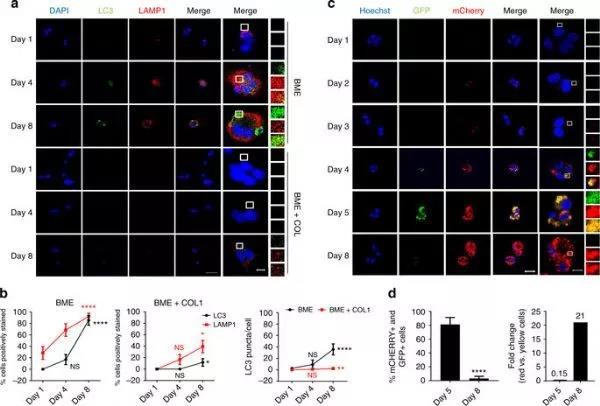
图片来源:Nat Commun
如何治疗癌症复发?
Cell Rep:靶向作用干细胞样细胞有望抑制卵巢癌复发
DOI: 10.1016/j.celrep.2019.02.032.
卵巢癌并不是一种最常见的癌症类型,但其却属于致死性最高的一类癌症,其复发率大约为70%,近日一项刊登在国际杂志Cell Reports上的研究报告中,来自匹兹堡大学等多个机构的科学家们通过研究成功利用一种新型药物杀灭干细胞样的卵巢癌细胞,从而就有效遏制了卵巢癌的复发。
文章中研究者发现,一种名为673A的新型实验性药物或能特异性地杀灭干细胞样细胞,这类细胞常常会在患者化疗后逗留;在卵巢癌小鼠模型中,将673A与化疗手段相结合或能明显改善癌症小鼠的生存率。医学博士Ronald Buckanovich说道,我们可以将干细胞样细胞想象为种子,其会生根发芽长成植物,当我们在治疗癌症时实际上类似于“修剪草坪”,但问题是蒲公英总会回来的。化疗会杀灭90%-99%的癌细胞,但干细胞样细胞会躲过化疗从而使得患者癌症复发,通常11个干细胞样的细胞就能够形成肿瘤,相比之下,移植5万个非干细胞样癌细胞而其无法形成肿瘤却是可能的,研究者指出,实验性药物673A能够通过靶向作用ALDH信号通路来杀灭这些干细胞样细胞,这些细胞会依赖于该通路来清除快速繁殖所产生的废弃物。利用673A来治疗卵巢癌仅能杀灭大约3%-5%的癌细胞,但由于这些细胞是干细胞样细胞,治疗的结果只能是给其重重的一拳。
研究者表示,将人类卵巢癌细胞注射到小鼠机体后,给予其化疗和673A联合疗法,其中60%的小鼠在6个月治疗后痊愈了,而仅接受化疗的小鼠却仅有10%的发生了痊愈。研究者发现,673A仅能有效抵御对化疗耐受性的肿瘤,当将673A和化疗结合起来治疗癌症小鼠时,几乎三分之二的小鼠在6个月病情发生了缓解,相比之下,仅接受化疗的小鼠会在同一时间段内死亡。研究者表示,未来有望将673A与化学疗法联合开发出组合性疗法来治疗卵巢癌,但目前他们还需要深入研究确定联合疗法最低的安全剂量,以便能够更好地降低患者机体出现的毒性副作用。
PNAS:新疗法可抑制肿瘤治疗后的复发情况
DOI: 10.1073/pnas.1803999116
最近,由Allison Gartung博士领导的一项研究以卵巢癌模型为研究对象,提出了一种新的抑制肿瘤细胞化疗后复发的方法。研究结果发表于1月份的《PNAS》杂志上。该研究证实化疗杀死的卵巢癌细胞诱导周围的巨噬细胞释放大量化学物质。这些被称为细胞因子和脂质介质的化学物质共同创造了有利于肿瘤生长和存活的环境。
图片来源:http://cn.bing.com
“传统的癌症疗法是一把双刃剑 - 用于控制癌症的治疗方法也有助于它的生存和发展,”BIDMC病理学系博士后研究员Gartung说。“为了防止肿瘤在治疗后复发,必须中和治疗产生的碎片固有的肿瘤促进活性。” 接下来,研究小组发现,一种名为PTUPB的新合成抗炎药物(专门用于靶向导致细胞因子和脂质介质的化学途径)能够阻止巨噬细胞受到碎片刺激的反应。此外,科学家们发现,PTUPB延长了携带卵巢肿瘤的小鼠的生存期并抑制了碎片刺激导致的肿瘤生长。
“化学疗法诱导的细胞因子和脂质的作用长期以来被低估,而卵巢癌患者可能会因为体内炎症因子的抑制而受益。”作者说道:“虽然需要进一步研究,但我们的研究结果表明,PTUPB可以通过抑制细胞碎片导致的炎症反应来补充常规癌症治疗。
CCR:联合疗法可有效治疗复发头颈癌
DOI: 10.1158/1078-0432.CCR-18-0327
像西妥昔单抗及放射疗法等肿瘤靶向疗法受到响应率低、可能发生耐药等因素的限制。在最近一项发表于《Clinical Cancer Research》的研究中,来自科罗拉多大学丹佛分校及科罗拉多大学安舒茨医学院的研究人员在科罗拉多大学安舒茨医学院放射肿瘤学科教授Sana D. Karam博士的带领下研究了EphB4-ephrin-B2促瘤信号在介导EGFR抑制剂和放射疗法治疗头颈癌产生耐药性过程中的作用。
研究人员使用人源头颈鳞状细胞癌(HNSCC)异种移植模型(PDX)和细胞系检测了他们的猜想。他们对肿瘤组织进行了受体酪氨酸激酶磷酸化检测,并采用蛋白免疫印迹实验检测了EphB4-ephrin-B2的表达变化。研究人员使用mRNA测序和微阵列数据分析对PDX肿瘤和HNSCC细胞系中与肿瘤细胞生长、增殖和生存信号通路相关的基因表达水平进行了检测。同时,研究人员还使用MTT实验检测了EGRF抑制剂和放疗不处理或者处理后HNSCC细胞的活性。
结果显示采用标准化疗和放疗治疗失败的局部恶性HNSCC病人的EphB4和ephrin-B2水平明显升高。研究人员发现抑制EphB4-ephrin-B2后采用西妥昔单抗及放射疗法治疗荷瘤小鼠会产生很显著的反应,小鼠生存期也得到延长。同时肿瘤生长抑制伴随着增殖、促生存信号的下调以及促凋亡信号的上调。
该研究表明采用恰当的联合疗法增强治疗效果至关重要。同时抑制EphB4-ephrin-B2并联合西妥昔单抗及放射疗法具有很好的临床转化前景,有助于提高这部分产生耐药性的病人的生存期。





 浙公网安备33010802007965号
浙公网安备33010802007965号