Global metabolic profiling identifies a pivotal role of proline and hydroxyproline metabolism in supporting hypoxic response in hepatocellular carcinoma
全代谢轮廓分析确定脯氨酸及羟脯氨酸代谢在支持肝细胞癌缺氧反应中的关键作用
期刊:Clinical Cancer Research IF:10.199
发表日期:2017.10
研究背景
代谢重编程是癌细胞的标志,也是研究人员感兴趣的永恒主题。癌细胞重新编程其细胞代谢,消耗更多的能量和材料,用于增殖、侵袭和转移。尽管不同肿瘤类型具有这些共同特征,但许多内在遗传损伤和外在非遗传影响也可能以肿瘤依赖性方式促成代谢异常。 为了提高癌症患者的存活率,更好地理解与特定恶性肿瘤相关的失调代谢是非常有必要的,以便为早期临床诊断和潜在的治疗干预提供有希望的机会。
在之前的研究中,肝细胞癌(HCC)肿瘤代谢的改变包括上调的糖酵解、糖异生和β-氧化以及下调的三羧酸循环。然而,氨基酸代谢在HCC发病机制中的作用尚未确定。致癌基因MYC可通过调节该途径中的酶促进谷氨酰胺/脯氨酸代谢,提示脯氨酸代谢参与肿瘤的发生。
实验设计
采用CE-TOF/MS对69对肝癌及邻近组织标本进行非靶向代谢组研究,对主要研究结果进行靶向代谢组学方法验证,同时结合生物学研究,探讨脯氨酸生物合成在肝癌发病机制中的作用。
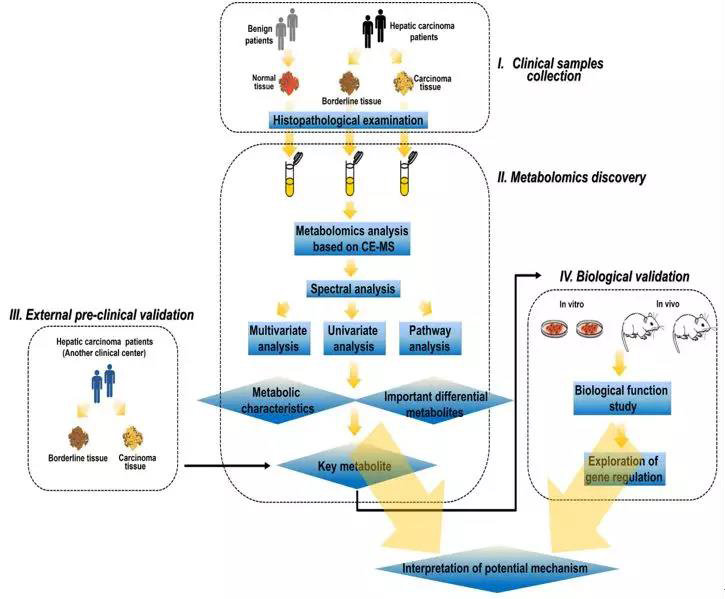
研究结果
代谢组广筛寻找关键差异代谢物
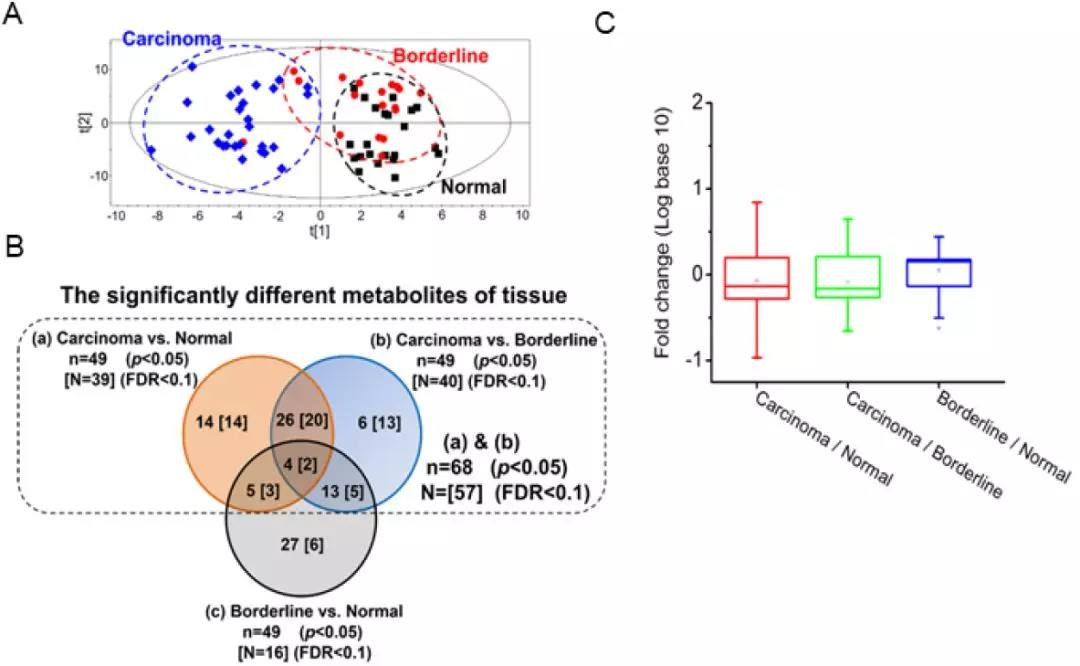
根据PLS-DA分析结果,肝癌组与(癌旁组织及正常组织)直接在代谢轮廓上有明显区分,而癌旁组织和正常组织之间也存在明显差异。结合多元统计分析VIP>1及单元统计分析p<0.05、FDR<0.05,与肿瘤有关的差异代谢物共筛选到13个。经通路分析发现,与同类物质相比,仅羟脯氨酸呈现独特的变化规律:从正常组织、癌旁组织、癌组织,含量递增。
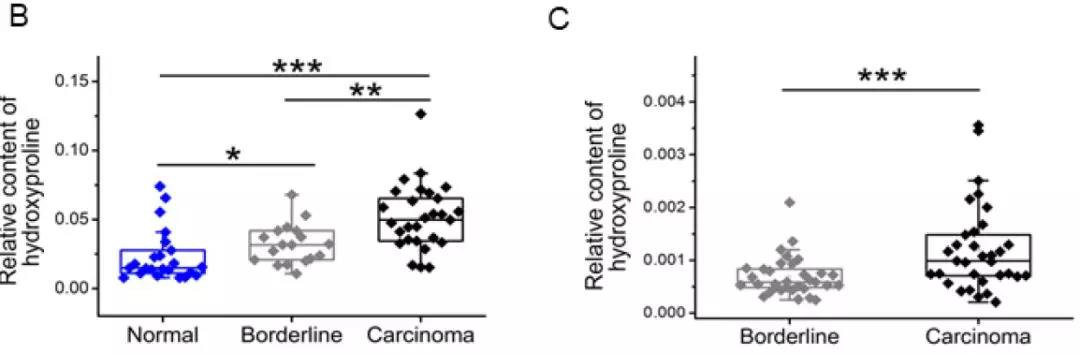
2. 关键差异代谢物的靶向验证
对发现集(69例样本)中的18对癌组织与癌旁组织进行靶向内部验证(图B),同时用来自另一临床中心的外部验证集的33对样本进行靶向外部验证(图C),发现羟脯氨酸变化趋势与广筛结果相符合。
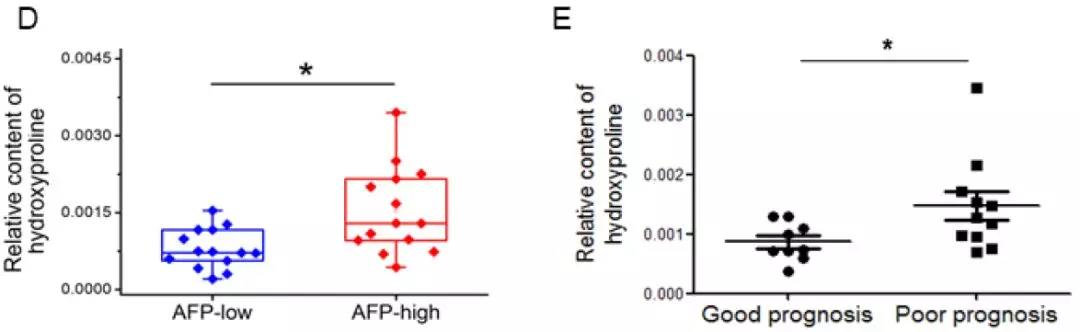
3. 羟脯氨酸与HCC发病机制间的相关性
通过对临床肝癌生物标志物AFP的检测发现,低含量AFP组呈现更低的羟脯氨酸含量,同时表现为更好的预后效果。即羟脯氨酸在肝癌的疾病进展中可能发挥着重要作用。
4. 羟脯氨酸积累的体外生物学功能验证
细胞侵袭能力评估表明,在低氧环境下,外界加入羟脯氨酸时,细胞的运动性及侵袭能力变强,而低氧诱导因子(HIF1α)含量增加。反之,当敲除HIF1α时,细胞活性会受到明显抑制。从而生成假设:羟脯氨酸是否是通过调节HIF1α依赖型表型来影响肿瘤的发展。
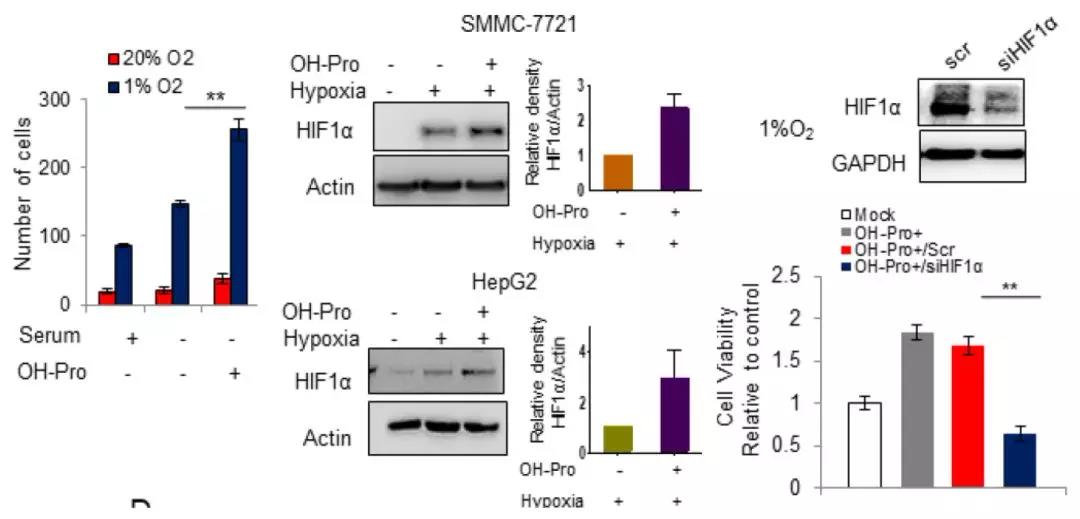
5. 羟脯氨酸积累的体外生物学功能验证
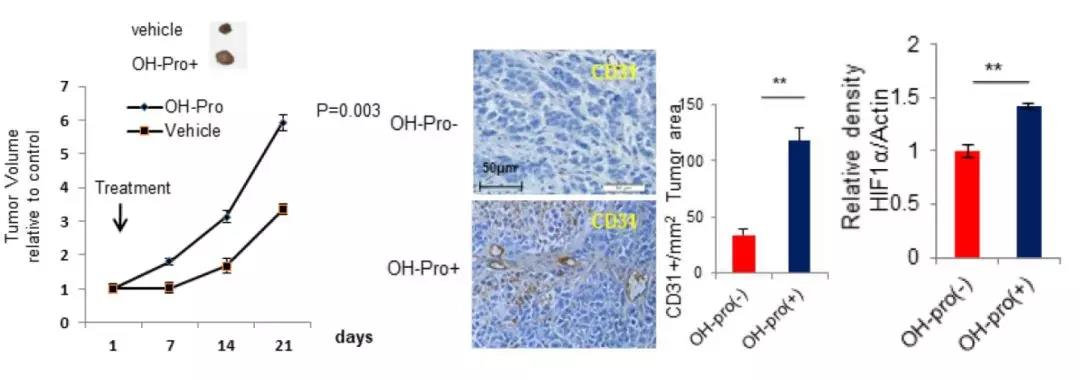
SMMC-7221细胞皮下注射小鼠(2组,每组5只生物学重复),一组为阴性对照组,另一组用羟脯氨酸处理。结果表明,3周后,羟脯氨酸组的肿瘤体积约为对照组的2倍,HIF1α水平上调,且Ki67免疫反应活性增加,揭示了羟脯氨酸在HCC机制中的促增殖作用。除此之外,免疫组化结果也显示,羟脯氨酸组的CD31水平上调,即肿瘤血管生成增加。因此,羟脯氨酸可通过调节HIF1α依赖型表型来影响肿瘤的发展。
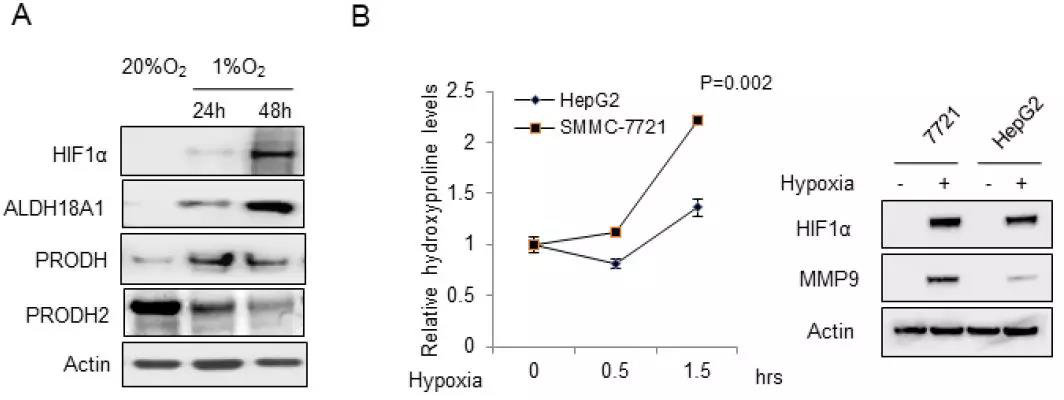
6. 体外验证(分子生物学手段)——羟脯氨酸积累调控生物学行为的分子机制
细胞实验结果表明,在低氧条件下,随时间增加,ALDH18A1(合成脯氨酸的关键酶)、PRODH(生成羟脯氨酸)的表达上调,而PRODH2(分解羟脯氨酸)的表达下调,与细胞中羟脯氨酸含量升高、HIF1α及MMP9表达上调的结论相符。
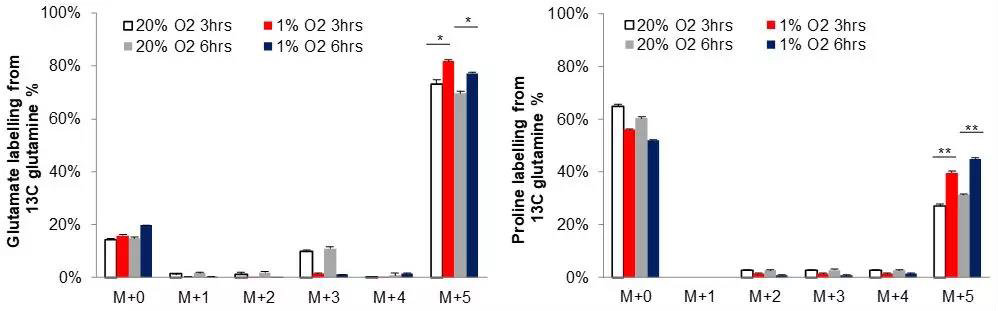
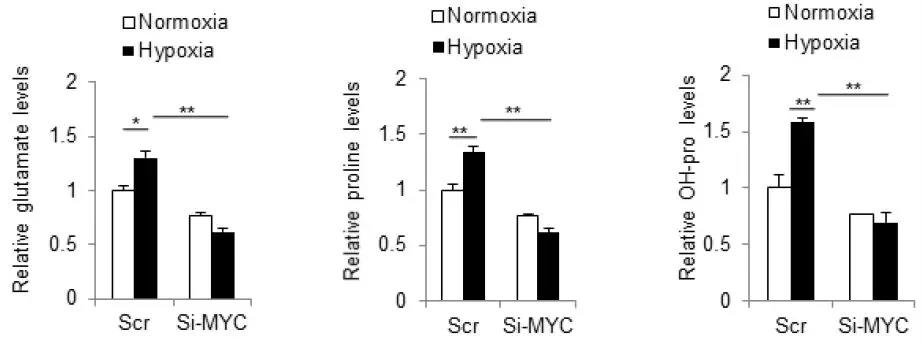
为确定是否低氧条件会促进肝癌细胞中脯氨酸产物的积累,用13C标记的谷氨酰胺处理细胞,同位素示踪实验表明,低氧会增加肝癌细胞中的谷氨酸及脯氨酸水平。
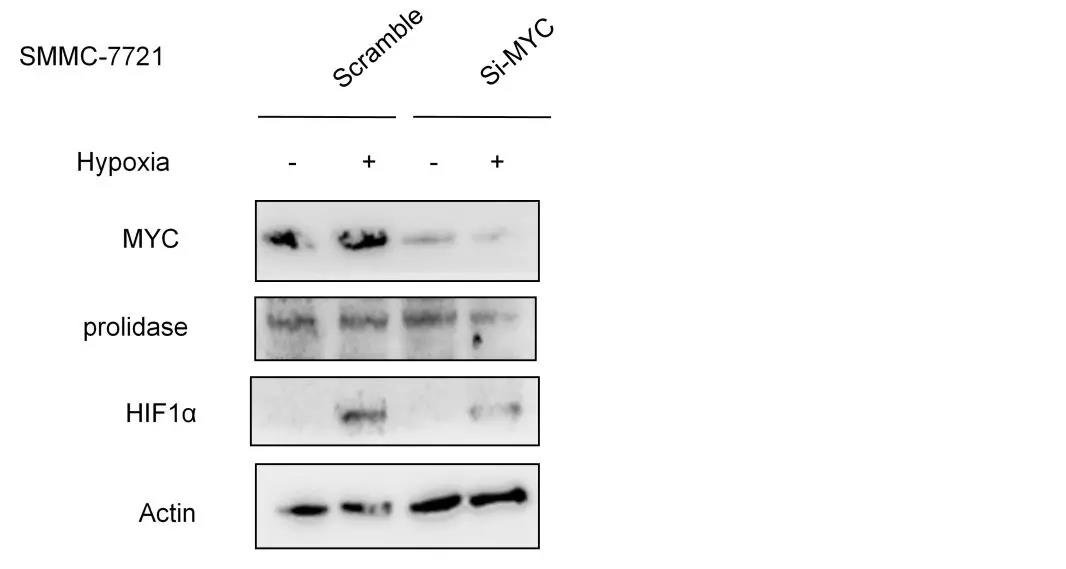
已有文献报道表明,HCC中致癌基因MYC通常处于被激活的状态,且通过调节谷氨酰胺酶(GLS)来控制谷氨酰胺的分解,于是作者假设MYC是通过影响谷氨酰胺的分解来调控低氧条件下脯氨酸的积累,为此再次进行细胞验证实验,敲除掉HCC细胞中的MYC基因,结果显示在3h内(低氧条件),谷氨酸、脯氨酸和羟脯氨酸的含量均降低,与ALDH18A1、MYC的变化呈正相关,但并不影响脯肽酶(PLD,它催化含有C-末端脯氨酸或羟脯氨酸2肽的水解,对胶原合成和细胞生长过程中脯氨酸的再循环起重要作用)的表达。
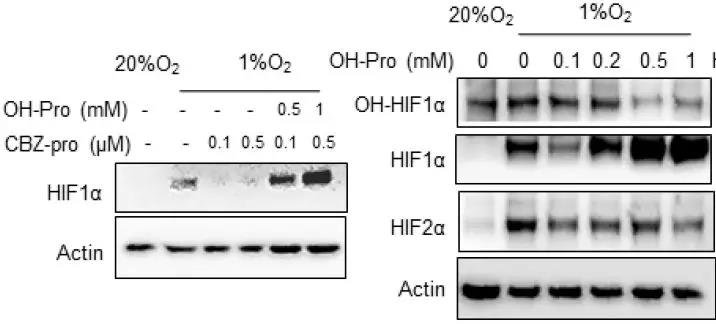
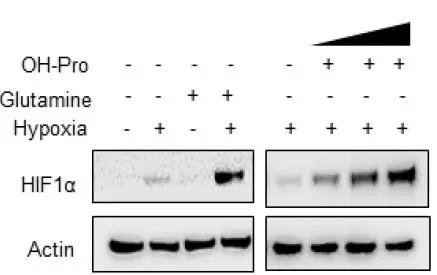
细胞内的羟脯氨酸只能来源于脯氨酸,脯氨酸被PHs(脯氨酸羟化酶)羟基化。在这种情况下,脯氨酸和羟脯氨酸可以通过PLD从原胶原中释放出来。当PLD被抑制时,低氧条件下HIF1α的表达被抑制,若额外添加羟脯氨酸,HIF1α的表达则显著增加。而随着羟脯氨酸的增加,羟化HIF1α呈现剂量依赖式抑制,HIF1α表达量增加。
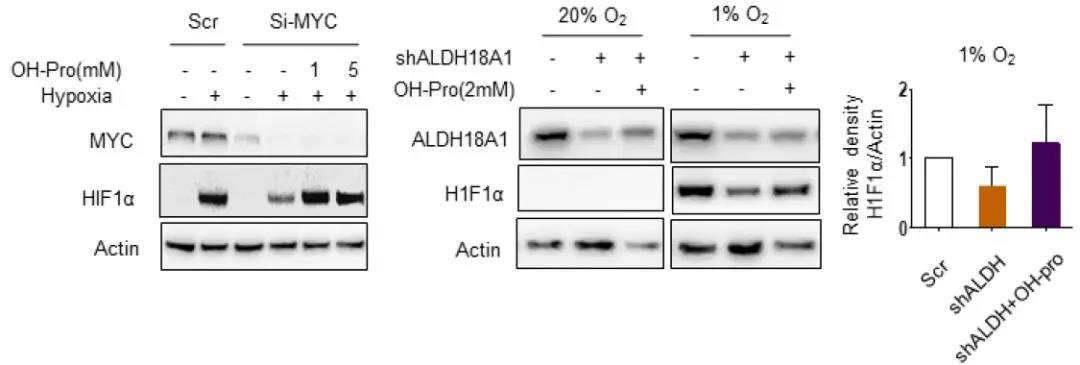
为了确定在MYC缺失时,外源性羟脯氨酸是否也具有稳定HIF1α的作用,对细胞中的MYC基因进行了敲除,当同时敲除掉ALDH18A1或是实行谷氨酰胺饥饿时,可显著降低HCC细胞的活性,而当外源添加羟脯氨酸时,HIF1α的表达及HCC细胞的活性均得到有效恢复。因此,谷氨酰胺-脯氨酸的转换对于调节HIF1α响应低氧至关重要。
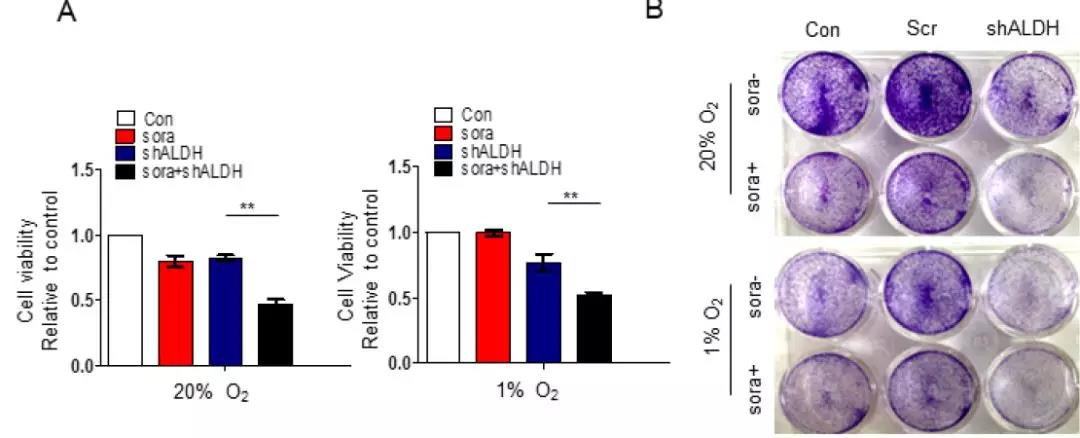
7. 寻找新的药物靶点——低氧条件下脯氨酸代谢影响HCC细胞存活及索拉菲尼耐药性
索拉菲尼是一种酪氨酸激酶抑制剂,应用于临床晚期肝癌的治疗。在对细胞进行ALDH18A1进行敲除后,在低氧条件下,使用索拉菲尼处理细胞,结果发现脯氨酸的合成被抑制,进而诱导细胞凋亡并提高HCC细胞对索拉菲尼的敏感度。也就是说,谷氨酰胺、脯氨酸和羟脯氨酸代谢轴通过调节HCC中的HIF1α来促进HCC发病机制和索拉菲尼的耐药性。
文章创新点
反复围绕假设——验证——假设——验证的思路,围绕一个中心点,将机制解析的非常透彻。很多老师做完代谢组以后就不知道该怎么往下走了,本文便提供了一个非常好的思路,值得咱们借鉴和学习。
“代谢组学”,找的是往下继续做的方向,它其实是刚开始,而不是有些老师以为的研究的最终点。我们首先通过组学寻找到切入点,再对切入点的代谢物进行准确定量,配以分子生物学手段进行联合验证,最终得到准确可靠的结果。





 浙公网安备33010802007965号
浙公网安备33010802007965号