编者按:口腔鳞癌(ral squamous cell carcinoma,OSCC)是头颈部恶性肿瘤最常见的类型,位列全球第八大肿瘤。OSCC有非常高的患病率和发病率,全球每年新增300,000例新病例,并有145,000例死亡。
标准的OSCC多模式管理主要是基于肿瘤-结节-转移(tumor−node –metastasis,TNM)来分类的,其中肿瘤的大小和位置以及是否存在转移被应用于临床上定义预后和治疗。然而,该系统存在若干缺点,例如具有相同TNM分期的患者表现出不同的临床行为、不同的治疗反应以及有着显著差异的临床结果。
尽管努力改善成像和治疗方式,OSCC预后(包括存活率)仍然很差并且变化很广泛,甚至在疾病的早期阶段也是如此,例如,在初始诊断时就可以检测到20-40%的隐匿性转移。此外,接受标准治疗的患者的OSCC复发率在18%至76%之间,局部复发就是其中一项治疗管理的临床挑战。因此,鉴定更多互补的生物表征来助力OSCC的预后预测是非常必要的。
近日,国际专业学术期刊Nature Communications上发表了蛋白组学运用于OSCC临床病理领域的相关研究。在该文中,研究人员通过蛋白质组学检测了肿瘤组织的不同区域,筛选到了6种潜在的表征蛋白,并通过IHC和靶向蛋白质组学进行了验证。最终发现表征蛋白确实可以加强OSCC的预后诊断,并且对肿瘤的复发以及淋巴结转移的治疗也有着非常好的指导意义。

研究人员对本文研究思路进行了缜密的设计,简要概述如下:肿瘤样品选择-切取相应组织-质谱样品准备和处理-质谱上机-结果分析-靶向验证。
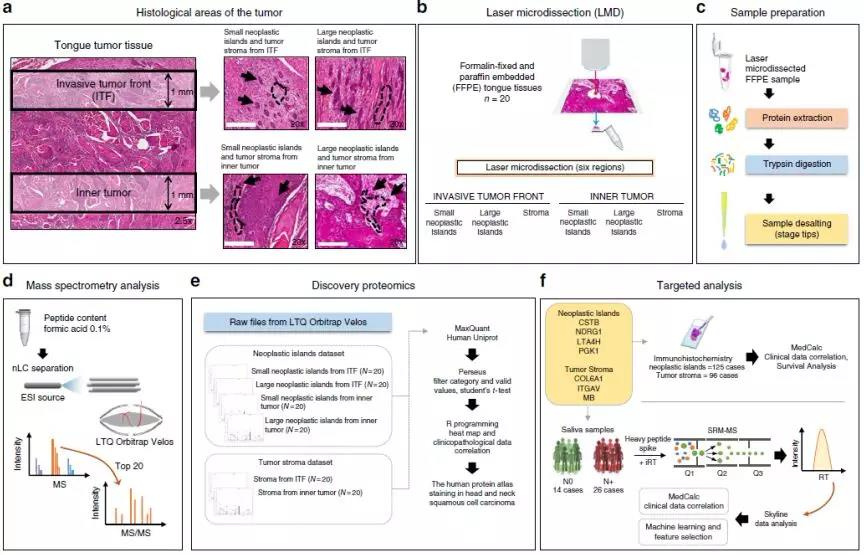
Fig.1 蛋白质组学研究技术路线图
样本选择:研究人员选取了20例相关病人的石蜡包埋组织,并且在每个组织中选取如下6个区域进行Label-Free蛋白质组学分析:(1) small neoplastic islands from the ITF; (2) large neoplastic islands from the ITF; (3) small neoplastic islands from the inner tumor; (4) large neoplastic islands from the inner tumor; (5) stroma from the ITF; and (6) stroma from the inner tumor.(注:ITF=Invasive Tumor Front)
质谱分析:相比于TMT/iTRAQ、SILAC等标记定量技术,Label-Free定量技术不受样本限制,可用于所有类型的蛋白质组检测,一般适用于差别较大的样本比较(如病理样本、不同的组织器官),以及关注“有无”差异的标志物蛋白筛选。
本文运用Label- Free定量蛋白质组学分析以上组织得到了大量的蛋白,通过一系列的生信分析和筛选并通过线性回归分析得到以下14种与病人特征相关的蛋白。
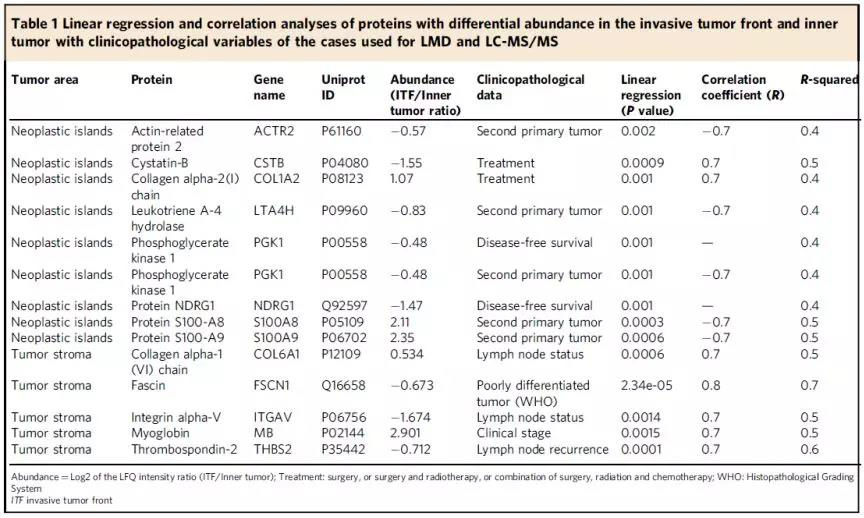
Fig.2 与病人特征相关的蛋白
而这些蛋白对于后续的IHC和靶向蛋白质组学而言还是较多的,所以作者又制定了筛选蛋白的标准:(1)只选择在ITF和肿瘤内部丰度有差异的蛋白;(2)只选择跟病人临床病症相关的蛋白;(3)只选择在人类蛋白质库(https://www.proteinatlas.org/)里染色阳性的蛋白;(4)只选择未见报道或者仅有少数报道跟口腔鳞癌相关的蛋白。
根据上述原则,最终研究人员锁定了如下7个蛋白:
Cystatin-B (CSTB), leukotriene A-4 hydrolase (LTA4H), protein NDRG1 (NDRG1), and phosphoglycerate kinase 1 (PGK1) from the neoplastic island dataset and collagen alpha-1 (VI) chain (COL6A1), integrin alpha-V (ITGAV) and myoglobin (MB) .
接下来,研究人员首先选取了14例病人石蜡组织对上述蛋白进行了验证,结果与组学结果一致。于是研究人员进一步将样本扩大,选取了125例肿瘤岛组织和96例肿瘤基质组织来进行IHC验证。结果也与组学结果基本一致。
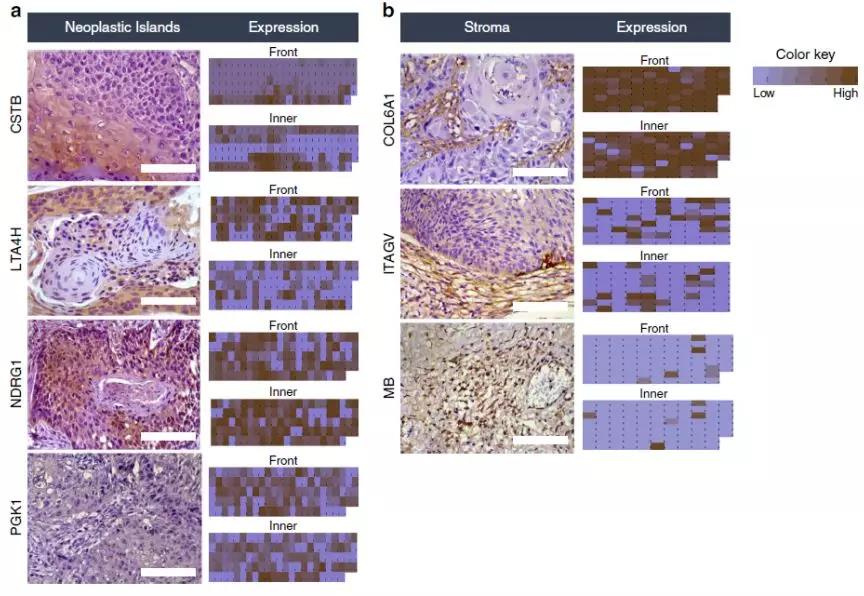
Fig.3 7个表征蛋白在病理样本中的验证
接下来研究人员选取了40例病人唾液进行了靶向蛋白质组学验证。首先,研究人员将这些样本分成了两组:没有淋巴结对的(N0)和已经发生淋巴结转移的(N+)。结果发现相比于N0组,N+组中CSTB, LTA4H, PGKI, NDRG1, COL6A1和ITGAV这6个蛋白表达丰度比较低,此结果表明这6个蛋白与口腔鳞癌的进展有着相关性。
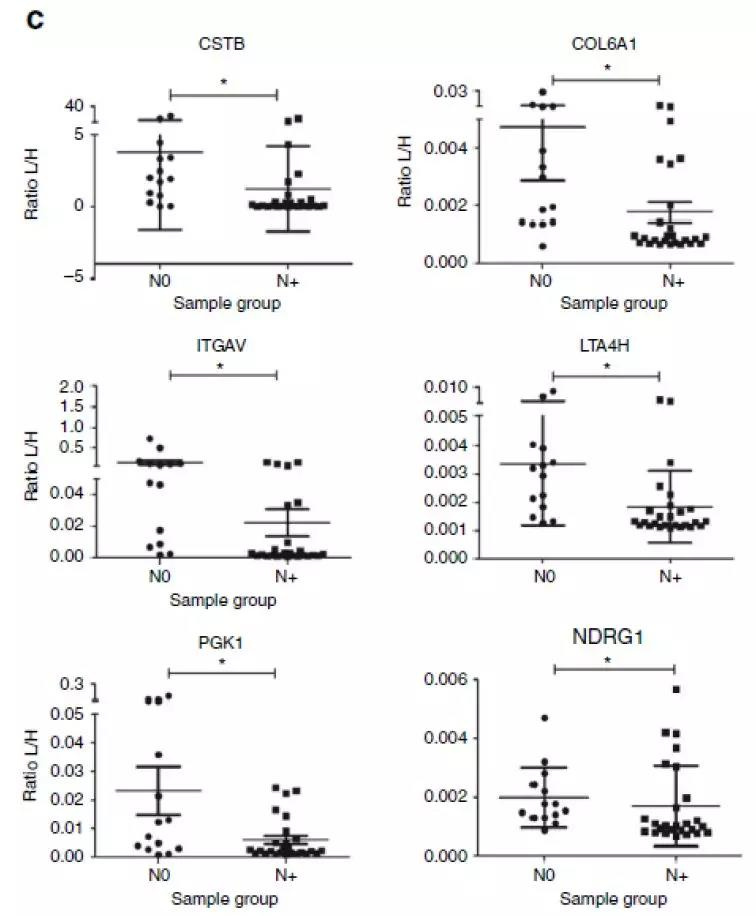
Fig.4 表征蛋白在40例病理唾液样本中的靶向蛋白质组验证
最终,研究人员通过对上述蛋白进行加权,并构建了一个预测模型用于指导后续的口腔鳞癌的预后诊断。
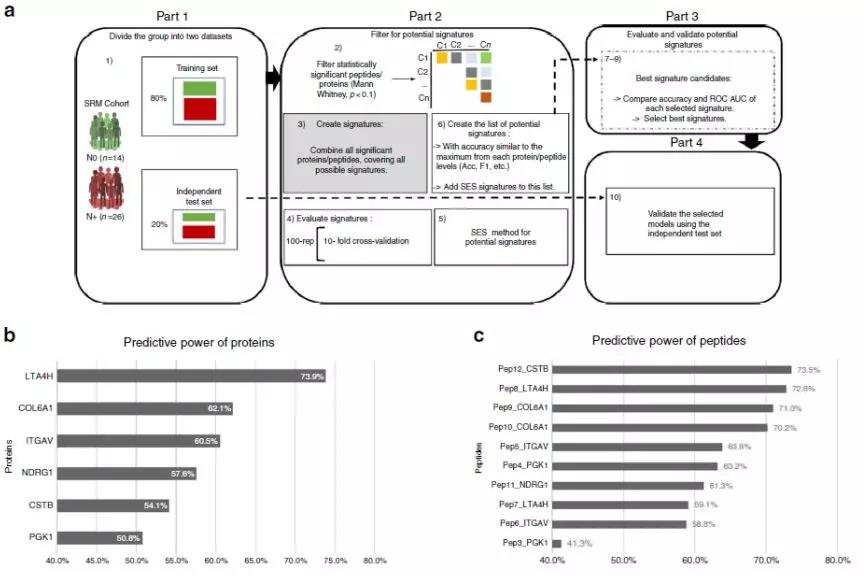
Fig.5 表征蛋白的临床预测模型
研究人员通过蛋白质组学检测了肿瘤组织的不同区域,筛选到了6个潜在的表征蛋白,并通过IHC和靶向蛋白质组学进行了验证。最终发现表征蛋白确实可以加强OSCC的预后诊断,并且对肿瘤的复发以及淋巴结转移的治疗也有着非常好的指导意义。
研究运用高通量蛋白质组学分析筛选,靶向蛋白质组学验证,堪称疾病表征蛋白分析的经典范例。研究同样说明以蛋白质组学为代表的组学研究,对于临床病理诊断的重要意义。蛋白质组学的研究能为多种疾病机理的阐明及攻克提供理论根据和解决途径,真正意义上实现疾病“精准治疗”无论在机制研究还是临床应用中“精准”的需求。
参考文献
Carnielli, C. M., et al. (2018). Combining discovery and targeted proteomics reveals a prognostic signature in oral cancer. Nature Communications.





 浙公网安备33010802007965号
浙公网安备33010802007965号