胆汁酸(Bileacid)是胆汁的重要成分,在脂肪代谢与多种生理病理过程中起着重要的调节作用。由于胆汁酸在疾病的诊断和鉴别中的重要价值,受到了广泛的关注。目前,血清总胆汁酸(TBA)的检测已成为临床上肝功能评价的常规项目。
胆汁酸的代谢主要包括胆汁酸的合成,胆汁酸的跨膜转运和肠肝循环。
人体内胆汁酸按结构不同分为两大类,一类称游离型胆汁酸,主要包括胆酸(CA)、脱氧胆酸(DCA)和鹅脱氧胆酸(CDCA)以及少量石胆酸(LA)、熊脱氧胆酸(UDCA);另一类称结合型胆汁酸,是游离型胆汁酸分别与甘氨酸或牛磺酸的结合产物。
从来源或生成部位可将胆汁酸分为初级胆汁酸和次级胆汁酸,在肝脏内由胆固醇生成的称为初级胆汁酸,而在肠道细菌的作用下转变为的是次级胆汁酸。
胆汁酸由胆固醇转变而来,这也是胆固醇排泄的重要途径之一。肝细胞内由胆固醇转变为初级胆汁酸的过程很复杂,需经过多步酶促反应完成。胆固醇7α-羟化酶(CYP7A1)是胆汁酸合成途径中的第一个限速酶,催化生成两个主要的初级胆汁酸—CA和CDCA。CDCA进一步生成α-MCA和β-MCA;随胆汁流入肠腔的初级胆汁酸在协助脂类物质消化吸收的同时,受肠道细菌的影响,一部分被水解、脱去7α羟基而转变为次级胆汁酸,包括TDCA,THCA,TMDCA,THDCA,TUDCA等[1](图1)。
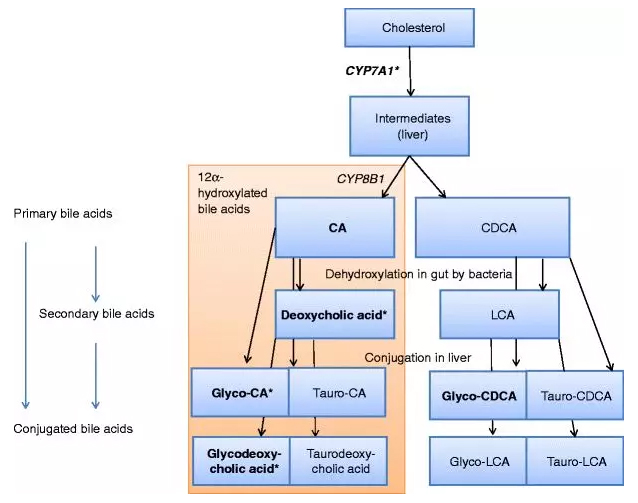
图1.胆汁酸合成途径[1]
胆汁酸的肠肝循环是调节胆汁酸合成速率的重要机制。结合型初级胆汁酸在肝脏合成后,随胆汁分泌入小肠,约90%~95%在回肠重吸收,经门静脉循环回肝脏,5%随粪便排出,而丢失的胆汁酸通过胆汁酸的合成来补充。
胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用,只有一少部分胆汁酸进入外围循环,因此血中胆汁酸浓度很低,这就要求检测方法的灵敏度要高,目前通过液质联用的方法一次可以检测到几十种胆汁酸代谢物[2]。
胆汁酸合成、分泌或运输的异常都会导致脂肪肝、胆结石、肥胖及糖尿病等疾病的发生。胆汁酸水平和性别、年龄和BMI都有着密切的关系。同时,胆汁酸可作为糖尿病或肥胖患者胃旁路手术治疗效果的预后指标,术前越高水平的血清鹅脱氧胆酸(CDCA),术后复发的可能性越大[3]。
在过去十几年的研究中,越来越多的证据表明胆汁酸代谢在T2DM病人中发生了变化,而通过调节T2DM患者的胆汁酸种类及含量可以改善血糖水平。胆汁酸水平的增加往往伴随着糖脂代谢平衡的改善,主要是通过两种胆汁酸的受体介导的——法尼基衍生物X受体(FXR)与G蛋白偶联受体TGR5。
因此,通过胆汁酸类似物调控与胆汁酸受体的相互作用可能是潜在的糖尿病治疗靶标[4](图2)。
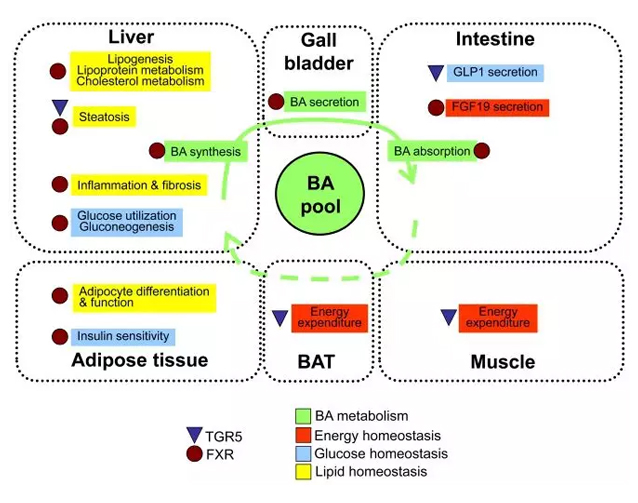
图2.胆汁酸代谢通路及其对能量和糖脂平衡的影响[4]
一项研究表明进入血液的胆汁酸表现像激素一样,作用于TGR5等受体,并影响不同类型细胞的行为。TGR5是一种由胆汁酸激活的受体,能够降低脂肪组织炎症和肥胖相关糖尿病中的胰岛素抵抗。
当研究人员用与胆汁酸类似的化合物激活TGR5受体后,TGR5引起了细胞内分子级联反应,降低了巨噬细胞的集聚,显著地减少了与T2DM有关的炎症反应[5]。因此,具有胆汁酸功能的分子通过作用于巨噬细胞的TGR5受体,能够成为新型抗肥胖及糖尿病的药物。
胆汁酸合成中最关键的限速酶是CYP7A1,另一项研究发现,过表达CYP7A1的转基因小鼠会减轻高脂饮食诱导的肥胖、脂肪肝以及胰岛素抵抗,形成一种保护作用。研究者进一步对这种转基因小鼠进行了系统的代谢组学与脂质组学研究,探究了这种整体胆汁酸改变的小鼠是具体通过怎样的脂质及胆汁酸代谢变化而起到保护作用的。
结果表明,脂质组学分析发现7种脂质分子在高脂饮食CYP7A1过表达的小鼠血浆及回肠组织中显著减少,在肝组织没有显著变化,并且正常饮食的小鼠脂质也没有明显变化。
这些变化的脂分子主要是溶血磷脂酰胆碱(LPC)、鞘磷脂(SM)及神经酰胺(ceramide)(图3),它们都与炎症及胰岛素抵抗相关。而代谢组学分析发现高脂饮食与CYP7A1过表达会使多种胆汁酸在胆囊、肝组织、回肠及结肠组织中有不同的显著变化,经过OPLS-DA模型的筛选共有13种显著差异的胆汁酸(图4)。
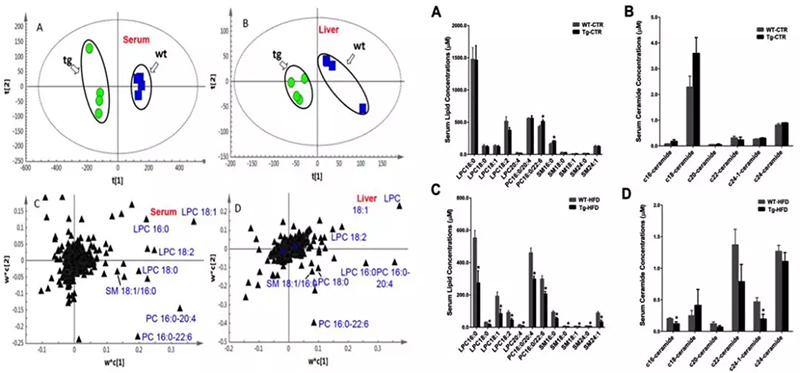
图3.PLS-DA筛选CYP7A1基因过表达的小鼠血浆中差异的脂质分子
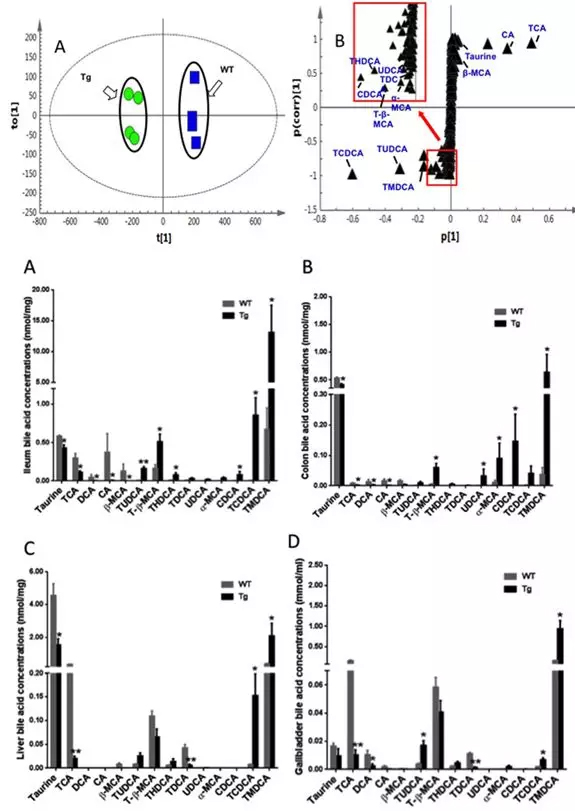
图4.OPLS-DA筛选CYP7A1基因过表达及高脂饮食诱导的小鼠不同组织中差异的胆汁酸分子
其中,12α-羟基胆汁酸(包括CA,TCA,DCA,TDCA)在CYP7A1过表达小鼠的不同组织中显著降低,进一步的基因表达检测发现是由于生成12α-羟基胆汁酸的关键酶CYP8B1表达受到显著抑制。同时,牛磺酸偶联的次级胆汁酸代谢物,尤其是TCDCA和TMDCA在所检测的四种组织中均显著上升。
因此,过表达CYP7A1不仅会影响不同初级与次级胆汁酸的含量变化,也会造成炎症相关的脂质分子减少,进而对高脂饮食诱导的肥胖及胰岛素抵抗起到保护作用[6]。
胆汁酸一方面是肝脏胆固醇分解代谢的主要途径,一方面促进肠道膳食脂肪的吸收。同时,胆汁酸也是糖代谢和脂代谢的重要信号分子,通过不同受体介导的多种信号通路发挥重要的生理作用。
综上所述,胆汁酸与糖脂代谢相关疾病有紧密地关联。然而,也许是缺乏足够的特异性与灵敏性,目前还没有研究发现胆汁酸可以作为T2DM的预警与诊断标志物,因此还有待进一步研究。
参考文献:
[1]FallT,SalihovicS,BrandmaierS,NowakC,GannaA,GustafssonS,etal.Non-targetedmetabolomicscombinedwithgeneticanalysesidentifiesbileacidsynthesisandphospholipidmetabolismasbeingassociatedwithincidenttype2diabetes.Diabetologia.2016;59:2114-24.
[2]GaoJ,XuB,ZhangX,CuiY,DengL,ShiZ,etal.Associationbetweenserumbileacidprofilesandgestationaldiabetesmellitus:Atargetedmetabolomicsstudy.ClinicaChimicaActa.2016;459:63-72.
[3]YuH,NiY,BaoY,ZhangP,ZhaoA,ChenT,etal.ChenodeoxycholicAcidasaPotentialPrognosticMarkerforRoux-en-YGastricBypassinChineseObesePatients.JClinEndocrinolMetab.2015;100:4222-30.
[4]PrawittJ,CaronS,StaelsB.Bileacidmetabolismandthepathogenesisoftype2diabetes.CurrentDiabetesReports.2011;11:160-6.
[5]PerinoA,PolsTW,NomuraM,SteinS,PellicciariR,SchoonjansK.TGR5reducesmacrophagemigrationthroughmTOR-inducedC/EBPβdifferentialtranslation.JournalofClinicalInvestigation.2014;124:5424-36.
[6]QiY,JiangC,ChengJ,KrauszKW,LiT,FerrellJM,etal.Bileacidsignalinginlipidmetabolism:metabolomicandlipidomicanalysisoflipidandbileacidmarkerslinkedtoanti-obesityandanti-diabetesinmice.Biochimicaetbiophysicaacta.2015;1851:19-29.





 浙公网安备33010802007965号
浙公网安备33010802007965号