第二代基因测序技术的发展,将基因组学的研究推向了高潮。很多生物学问题,“测个序”或许就能找到关键性基因。一般的全基因组测序涵盖25000个以上基因,相比起来,全代谢组学能够测量的代谢物也就1400多个。虽然数量少,但是由于代谢物能够更加直观反映生物学表型的特点,过去20年代谢组学可以说是越来越火。
小编将给大家分享代谢组学在生物研究的应用该注意的方方面面。这些内容对于想要了解,或者在试验设计中使用质谱分析代谢组学的砖工们有很大借鉴意义。
一、基本研究方法
从代谢物的覆盖程度上分,代谢组学可以分为两种:全代谢组学和靶向代谢组学。
全代谢组学,顾名思义,就是把所有的代谢物都检测一遍;而靶向代谢组学,就会更有重点的看某些代谢通路,比如三羧酸循环、糖酵解等。对此,方教授建议,虽然全代谢组学的覆盖面更广,但是灵敏度不够;如果有一些实验或者文献的线索,还是看靶向的代谢组学比较好。
此外,这几年脂质代谢组学也有一些发展,属于新兴领域。由于脂质的理化特性和多数代谢物不同,脂质代谢组学需要用普通代谢组学不同的分离方法。
代谢组学的工作流程如下:
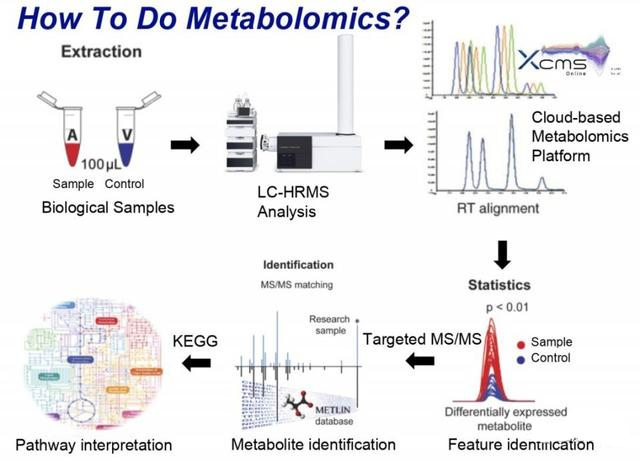
首先是提取“用药组”和“对照组”的样品,之后气相质谱(GC-MS)或者液相质谱(LC-MS)来获取数据,核磁共振(MRI)使用相对比较少。
数据的分析是代谢组学中非常重要的部分,需要调整很多参数,再用统计学分析来确定到底哪些代谢物发生了变化。重要的信息包括:Retentiontime;accuratemass等。然后将变化的数据进行代谢组通路分析,一般用KEGG数据库。同样的,这些数据库现在脂质代谢的相关信息还很少。
二、学术研究举例
虽然大家之前对代谢组学来发现生物标记物等寄予厚望,但是现实还是比较残酷的。因为代谢物相对疾病的特异性不够强,很多病因可能会导致同一个代谢物的变化,所以很难通过一个代谢物来判断是否得了某个疾病。现在有些通过一组代谢物变化来进行判断的模型,但是还没有看到临床应用的。
那么学术界的研究热点在哪些方向呢?
比较有意思的一个概念是metabolicregulation,讲的是代谢物调控基因表达。
以往都认为是基因调控酶的表达,进而调控代谢。最新的一些研究发现,某些代谢物在细胞里的含量,会影响细胞的基因表达,甚至细胞命运。这是相互影响的过程,是双向的。
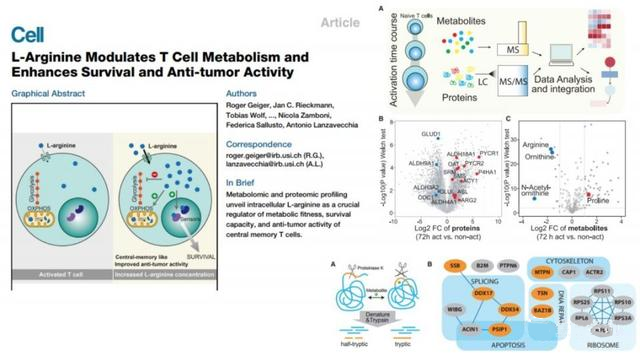
举例说,去年Cell的这篇文章,就发现免疫T细胞在分化过程中,精氨酸的含量发生了很大变化。改变精氨酸的浓度,能够改变T细胞的命运。
又比如,Science上发过哈佛和MIT做的一个研究,对60个肿瘤细胞系做了代谢谱,发现癌症中的甘氨酸的含量能够反映肿瘤细胞的生长速度,并且合成甘氨酸的酶表达量高的乳腺癌病人预后较差。
另一个方向是做“精准医疗”。
不同病人,同时吃一种药,有些人效果好,有些人效果不好,为什么?是不是能够通过分析血液样品的代谢组学来对病人的药物敏感度提前做出预测。这一领域现在基因测序比较多,代谢组学做的还相对比较少。当然,对于代谢组学最终是否能够起到这样的作用,也有一些争议。
最后提到的学术研究方向,通过新的研究手段,重新书写一些生化理念。
以往有很多概念,是经验积累,因为技术条件的限制没有办法检测。而现在的技术能够重新分析和研究这些问题。
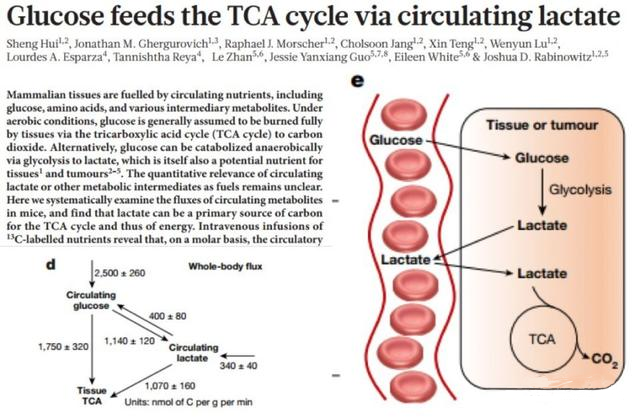
比如,Nature上去年发了一篇文章,通过非放射性同位素标记法,发现葡萄糖通过无氧糖酵解产生的乳酸能够继续回到三羧酸循环TCA,为机体产生能量。这一部分研究未来应该还有大的发展。
三、实验设计注意事项
一个做生物学研究的同学,如果希望用代谢组学来得到一些数据该注意些什么呢?
首先,要弄清楚你研究的这个生物学问题,代谢组学能不能解答一些问题,也就是到底需不需要做这个实验。
有一些情况下代谢组学的变化不会特别大,可能观察不到变化,那就浪费了时间。一般来说变化比较大的是代谢病和肿瘤。近些年在免疫反应、干细胞、表观遗传学方向上运用比较多,但是每一个课题研究者都需要对研究对象有深入的了解,再通过代谢组学来研究具体问题。
其次,如果确定需要做了,要在实验前和技术部门进行沟通,了解样品处理的每一个步骤,保证不出错。
比如很多代谢物不稳定,样品收集过程一定要低温;要多少细胞、组织才有足够的样品量,样品量过小会导致很多代谢物无法被检测到;要设计好对照组,这样才能有可靠的对比;还有样品具体该收集多少个重复组;到底想分析普通代谢组还是脂质代谢组等等。
再次,最好能找有经验的专家进行讨论来设计具体怎么看代谢物变化。我们建议先看看大体的变化,之后在着眼到一个通路上的。
如果是做非放射性同位素标记的实验,就有更多要注意的:同位素标记位点的选择、样本采集的时间点都很重要。一般需要做预实验来确定在某个实验体系中代谢物转化需要的时间。这一类实验对设备要求比较高,也比较昂贵,实验前要详细论证。
最后一点,尽管是“组学”的数据,研究员还是需要有比较明确的“假设”,即hypothesis。因为变化的代谢物很多,到底哪个代谢物的变化是最关键的,可能还是需要实验和文献阅读来缩小范围。
四、产业应用前景
代谢组学的工业化应用,目前为止没看到大的市场。现有的一些公司,主要是给高校、研究所做服务。
有一些在研发中的应用:
1.临床上寻找生物标记物。虽然现在没有被批准的用质谱检测生物标记物的方法,但是后续如果研发出靠谱的生物标记物,市场会很可观。因为相比于稳定的基因组学,代谢组学是不断变化的,一个病人可能在疾病不同阶段需要进行多次检测。
2.医疗上可能取代一些酶联免疫标记实验(ELISA),因为质谱的特异性会更高。有希望开发出一些常规的检测项目,比如呼气诊断肺癌。
3.给富裕人群制定具体的营养学方案。代谢组学可以检测出体内缺什么营养物质,从而知道需要通过什么样的膳食结构来改善健康。
4.药物代谢组学。像之前提过的,通过代谢物变化来知道个人体内哪些酶活性高,从而预测药物在个体病人身上的效果、副作用等。
五、领域内的技术挑战
代谢组学应用的局限,很大程度来自于领域内一些技术瓶颈:
1.代谢物的覆盖度有限。一是不同代谢物理化性质差异很大,没办法都能够提取出来检测;二是一些代谢物质谱的方法不容易检测到;三是一些代谢物含量太低,所以检测不到。
2.如何确定是哪个代谢物的变化。现在还有很多代谢物没办法确定结构,这些数据就没用了。
3.不能做到高通量。现在的方法一个样品要跑半个小时,有时候为了覆盖度好还要多跑几遍,考虑到重复组和对照组,工作量就很大了。
4.代谢组的数据分析不容易,现在还需要有经验的专门的分析员来做。未来希望能够有简单的工具给各个方向的研究员使用,但是暂时还没有。
5.数据的可重复性。生物体内能够干扰代谢物组成的变化很多,所以做实验的时候要设计好控制对照,保证同样的条件,否则温度、时间等因素对结果的影响都很大。
6.已知的代谢网络还是有限的,有一些可能有意义的变化会因为在分析时被忽略。





 浙公网安备33010802007965号
浙公网安备33010802007965号