1.Science:癌基因蓝图绘制成功,或能推动个体化医疗的进程
doi.1126/science.aan2507

在最近发表在《Science》杂志上的一篇文章中,研究者们绘制出了与主流癌症相关的病理学基因蓝图,展示了每个蛋白表达水平的差异究竟会对患者的生存期产生怎样的影响。这一蓝图的成功绘制将助力于精准医疗与个体化癌症治疗的发展。
这一蓝图是基于对8000名患者的17中主要癌症类型进行分析而得出的,此外还加入了患者的存活数据。利用超级计算机技术,总共能够对2.5PB的数据进行分析,并声称超过900000份存活图表,它们详细地描述了体内蛋白质以及RNA的表达差异与患者临床存活时间的关系。
"人类蛋白质蓝图计划"联盟的主任同时也是该蓝图的主要领导之一MathiasUhlen教授称:"这项研究与以前的癌症相关研究都不相同,它并没有专注于癌症特有的突变,而是对癌症相关突变引发的下游效应进行了系统性的分析。我们第一次发现了基因的表达差异对于患者寿命的影响,这就是'大数据'在临床研究中的意义。它也提醒我们研究者们要时刻注重数据的共享与相互学习"。
这篇文章揭示了癌症生物学领域许多重要的发现。首先,它发现一些基因在癌症组织中存在差异化表达,而在大多数情形下这些变化都会影响患者的存活;此外,该研究还发现不同的肿瘤组织中某一特定基因的表达量也有显著的差异,患者寿命的缩短伴随着一些与细胞分裂以及生长的基因表达量的上升以及一些与细胞分化相关基因表达量的下降有关;这些数据还表明,对癌症患者建立基因组规模的个体化代谢模型有助于发现与肿瘤生长相关的关键基因。
研究者们希望这一蓝图的问世能够帮助研究者们发现与癌症个体化治疗相关的生物学标志物。
2.NatMed:中国科学家发现新型前列腺癌生物标志物有望改善癌症的个体化疗法
doi:10.1038/nm.4379

近日,一项发表在国际杂志NatureMedicine上的研究报告中,来自中国复旦大学和梅奥诊所的研究人员通过联合研究鉴别出了前列腺癌对疗法产生耐受性的一种新机制,相关研究或为后期开发新型前列腺癌疗法提供思路和希望。文章中,研究者解释了SPOP基因中的突变在前列腺癌对药物产生耐受性上所扮演的关键角色,SPOP基因突变是原发性前列腺癌中出现最为频繁的遗传突变,这些突变在癌症对BET抑制剂药物产生耐受性上扮演着重要的角色。
BET(bromodomainandextra-terminaldomain,溴域和额外末端结构域)抑制剂是一类能够抑制BET蛋白活性的药物,而这些蛋白能够帮助指导癌细胞的异常生长。作为一种疗法,BET抑制剂非常具有治疗潜力,但经常会发生药物耐受性。前列腺癌是美国男性最常患的恶性肿瘤之一,其也是引发美国男性死亡的第三大癌症,改善前列腺癌的治疗是美国重大的公共健康目标之一。
研究者表示,SPOP基因的突变能够稳定BET蛋白抵御BET抑制剂的活性,而且该基因突变还能够促进癌细胞增殖、侵袭及生长;研究者HaojieHuang博士表示,本文研究发现对于后期开发前列腺癌的新型疗法具有非常重要的意义,因为SPOP突变或BET蛋白表达水平的升高都能够用作生物标志物,来改善BET抑制剂导向疗法治疗SPOP突变或BET蛋白过表达相关癌症的效率。SPOP突变也能够被用来指导前列腺癌患者的抗癌疗法。
本文的研究要点如下:
1、BET蛋白(BRD2、BRD3和BRD4)是SPOP基因真正的降解基质;
2、SPOP基因的突变能够诱发前列腺癌患者样本中BET蛋白表达水平的升高;
3、SPOP基因突变体的表达会诱发对BET抑制剂耐药,同时还会激活AKT-mTORC1通路,促进癌变细胞的生长和存活;
4、共同施用AKT抑制剂能够帮助克服SPOP突变的前列腺癌对BET抑制剂的耐药性,梅奥诊所技术商业化部门MayoClinicVentures在前列腺癌生物标志物和疗法开发上拥有一项专利技术。
3.CellChemBiol:科学家有望让个体化癌症疗法成为现实
doi:10.1016/j.chembiol.2017.05.023

个体化治疗的其中一个目标就是通过对患者的基因组进行测序来确定哪种疗法能够发挥最佳的效果,如今来自康奈尔大学的研究人员就通过研究让这种目标成为了现实;研究人员利用名为"T-REX"的新型化学操作步骤结合实验室中开发出的靶向分子对多个已知的癌细胞突变进行了深入研究,相关研究刊登于国际杂志CellChemicalBiology上,该研究或有望帮助指导患者的疗法选择并且有效改善患者的治疗效果。
文章中,研究者YimonAye说道,人们往往想知道为何特定的药物在某些患者机体中有效,而在其他患者机体中则无效;本文中我们通过研究提出了新的见解,同时也设计出了新型的抑制剂来帮助有效治疗那些携带特殊突变的患者。研究者揭示了细胞内部所发生的氧化还原信号如何影响特殊酶类的活性,以及特殊酶类的氧化还原特殊过程如何通过靶向药物来调节。
为了确定哪种信号能够影响特殊蛋白的反应,研究小组利用T-REX步骤结合一种广泛使用的策略剔除了含有特殊蛋白的细胞;研究者所面临的一个挑战就是,相同蛋白的多个亚型都能够催化相同的细胞过程,但生物学的微妙之处就在于这些单一的亚型都具有特殊的调节机制。
研究者指出,某些亚型蛋白或许对于特定类型的肿瘤或细胞非常重要,因此对这些蛋白亚型进行有效区分或许非常重要。不同细胞信号通路之间的相互交联或许依赖于特定转录因子Nrf2的调节,实际上这其中的机制研究者并不清楚,除非利用新型方法来选择性地刺激Nrf2信号。
癌细胞中蛋白链的N端关键突变或许会使得癌细胞对于特性靶向疗法变得更加敏感;Aye指出,我们所发现的研究结果或许能作为一种新方法来靶向作用N末端携带选择性突变的癌细胞;深入来讲,我们还需要对患者进行分型来观察是否其携带有这些突变,同时还需要确定是否这些患者会对激活抗氧化反应的小分子产生特殊反应。
最后研究者表示,理解癌症发生的复杂特性以及信号通路的互联机制或许能够帮助我们开发治疗癌症和其它多种疾病的新型疗法,后期我们将会通过更为深入的研究理解细胞中信号交联的机制来设计出更多新型选择性疾病靶向疗法。
4.2017AMSNMMI:个体化疗法或可明显改善神经内分泌癌症患者的生存质量
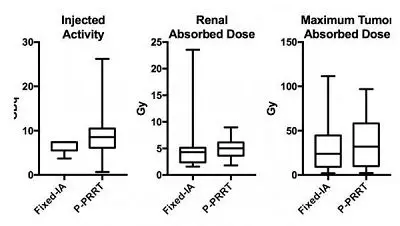
在2017年美国核医学和分子成像学会年会上,来自拉瓦尔大学的研究人员表示,神经内分泌癌症是一种非常难以处理而且无法治愈的癌症,但通过对患者进行个体化剂量的肽受体放射性核素治疗(PRRT)后或许就能够减缓患者机体肿瘤的进展,并且提高患者的生存率。
PRRT是一种相对罕见的疗法,其非常容易忽视神经内分泌肿瘤(NETs),研究人员希望能够开发出靶向性的疗法来吸附肽类受体阳性的肿瘤,同时还能够保留那些系统性疗法损伤的集体组织。医学博士Jean-MathieuBeauregard表示,截止到目前为止,大部分的PRRT疗法都采用一刀切的原则,这也就意味着,每位患者都能够接受到相同量的放射性物质,最终就会使得机体器官和肿瘤吸收高度可变的吸收辐射剂量,很多患者并不会因为这种疗法而获益,因为相比机体的承受能力而言,他们终止了小辐射剂量的治疗。
在研究中,研究人员利用了一种名为镥-177-octreotate的PRRT疗法,这种疗法能够模拟生长抑素的作用,一般情况下,在多个连续周期的治疗中,患者都会接受固定剂量的放射,比如200毫居里,因此,根据调节后的SPECT剂量测定,镥-177-octreotate疗法就能够同患者个体的耐受性匹配,SPECT能够评估患者机体中关键器官,比如肾脏中的放射性水平。
从2016年4月至12月,27名神经内分泌肿瘤患者接受了55个镥-177-octreotate疗法周期,随后进行定量的SPECT剂量评估,研究人员会对肾脏中的放射剂量进行量化来优化放射的使用,同时还能够保证患者的耐受性和安全;研究结果表明,大部分患者机体肿瘤中的放射剂量会出现增加,相比常规PRRT而言,肿瘤中放射剂量是前者的三倍。此外,由于个体化方法的使用,严重副作用和毒性影响状况在患者中出现的频率也下降了。
后期研究中,研究者计划在接下来几个月里通过更为深入的研究来确定个体化的PRRT方法到底是如何改善患者的治疗效益的,比如降低肿瘤进展,并且延长患者的生存。
5.Nature:黑色素瘤个体化疗法开发取得重大进展!
doi:10.1038/nature22079
尽管基于阻断程序性细胞死亡1受体蛋白(PD-1)的免疫疗法能够成功治疗转移性的黑色素瘤患者,但仍有超过一半的患者并不会通过看到肿瘤萎缩而获得长期的治疗效益,其中一种可能性的原因就是药物并没有在这些患者机体中发挥应有的作用,这些PD-1阻断药物在很多患者机体中缺少一种生物学效应;然而,最近一项刊登于国际杂志Nature上的研究报告中,来自宾夕法尼亚大学等机构的研究人员通过研究表明,实际上,大约80%的患者机体中对这些疗法产生反应的T细胞数量都会增加,PD-1靶向抗体pembrolizumab是一种检查点抑制剂药物,其能够有效抑制PD-1受体从而就能够促进T细胞复制并且对癌细胞产生强烈的反应。
但为何促进肿瘤收缩和增加患者机体中T细胞的数量之间存在一定的脱节关系呢?这项研究中研究人员就给出了一定的研究线索;E.JohnWherry教授指出,我们发现,患者机体中治疗前肿瘤的尺寸能够确定T细胞对药物产生反应来抑制患者机体肿瘤的强度,肿瘤尺寸越大,药物所激活的T细胞的活化能力就会越强,很多患者经历的临床失败并不仅仅是因为机体免疫系统无法被激活,而且还因为T细胞再度活化的强度和机体原始肿瘤负担失衡所致。
利用pembrolizumab治疗前后IV级黑色素瘤患者机体中外周血的免疫分析结果,研究人员就鉴别出了疗法开始时相比肿瘤尺寸而言循环T细胞所发生的的改变,同时研究者还对47名患者机体的血液改变进行了研究,这些参数之间的关系或许能够帮助深入阐明患者机体对免疫疗法的反应。JeddWolchok博士表示,这项研究能够帮助回答一些关键的问题,即为何某些患者对抗PD-1抑制剂疗法并无反应而为何有些患者却能够产生反应,我们想通过研究理解利用抗PD-1抗体疗法治疗患者时其机体免疫系统所发生的变化,同时对这些患者机体中发生的免疫学变化进行定性研究。
当黑色素瘤患者对PD-1阻断剂没有反应时,并不完全是出于同样的原因,但将免疫反应重新激活机体同肿瘤负担进行联系时,研究者提出了检查点抑制剂疗法失败的三种原因,即这种疗法并不能有效促进机体免疫反应再度激活,相比肿瘤尺寸而言免疫效应不充足或者药物发生了脱靶。Wherry说道,这项研究中我们鉴别出了多种疗法失败的情况,这对于后期开发新一代治疗措施非常关键。
研究者表示,当新型疗法使用后3-6周,他们将会利用这种方法来检测其它患者是否会因这种药物而获益,在PD-1临床试验中,其相比正常12周的重点疗法要早6周,如果患者并不会因pembrolizumab而获益,临床医生就会采用其它类型的药物来放大患者机体对第一种药物的免疫响应,他们会将额外疗法同首次PD-1阻断剂疗法失败的类型相匹配来对患者进行治疗。
最后,研究者Wherry说道,这是一种新型的疾病疗法模式,即将治疗前的肿瘤尺寸同免疫反应的强度相匹配来对疗法的成功性及失败进行特性分析;此外,通过重点关注临床上相关但却在血液中非常罕见的细胞类型,研究人员,研究者或许就能够深入理解在患者治疗期间肿瘤远端位置所发生的免疫事件。





 浙公网安备33010802007965号
浙公网安备33010802007965号